Resumo Reunião Científica - Índices prognósticos anátomo-patológicos no câncer de mama
Reunião científica Sociedade Brasileira de Mastologia - Regional Santa Catarina
Palestrante:
Dra Dr. Gianfranco Luigi Colombeli
Debatedores:
Dra. Daniella Serafin Couto Vieira,
Dra. Maria Eduarda Meyer,
Dr. Ygor de Oliveira
Índices prognósticos anátomo-patológicos no câncer de mama
Importante citar que o laudo anátomo-patológico, construído na ocasião da avaliação de casos de câncer de mama, costuma seguir as recomendações do Manual de Laudos da Sociedade Brasileira de Patologia e os Protocolos para Laudos Anátomo-Patológicos de Câncer de Mama do Colégio Americano de Patologistas (CAP) (1 e 2).
Um dos itens prognósticos mais importantes é a graduação anátomo-patológica. Tal graduação segue critérios bem estabelecidos, entretanto deve-se lembrar que o câncer de mama é uma neoplasia muito heterogênea e que tal graduação é observador dependente, ou seja, dois patologistas podem fornecer graduações distintas observando a mesma lâmina. Outros fatores também podem influenciar e provocar variações nos laudos, seja de materiais diferentes (biópsia x peça cirúrgica), seja entre diferentes laboratórios/patologistas avaliando o mesmo material/lâmina, tais como: fixação inadequada (autólise), formol não tamponado (imuno-histoquímica inconclusiva ou falso-negativa), uso do cautério (artefatos térmicos que impedem a avaliação adequadas das características celulares, arquiteturais e de margens cirúrgicas), entre outros (3).
Abaixo, os critérios reproduzidos na íntegra do protocolo do CAP (1 e 2).
Glandular (Acinar)/Tubular Differentiation
___ Score 1 (>75% of tumor area forming glandular/tubular structures)
___ Score 2 (10% to 75% of tumor area forming glandular/tubular structures) ___ Score 3 (<10% of tumor area forming glandular/tubular structures)
___ Only microinvasion present (not graded)
___ No residual invasive carcinoma after presurgical (neoadjuvant) therapy ___ Score cannot be determined
Nuclear Pleomorphism
___ Score 1 (nuclei small with little increase in size in comparison with normal breast epithelial cells, regular outlines, uniform nuclear chromatin, little variation in size)
___ Score 2 (cells larger than normal with open vesicular nuclei, visible nucleoli, and moderate variability in both size and shape)
___ Score 3 (vesicular nuclei, often with prominent nucleoli, exhibiting marked variation in size and shape, occasionally with very large and bizarre forms)
___ Only microinvasion present (not graded)
___ No residual invasive carcinoma after presurgical (neoadjuvant) therapy ___ Score cannot be determined
Mitotic Rate
___ Score 1 (≤3 mitoses per mm2) (see Table 1)
___ Score 2 (4-7 mitoses per mm2) (see Table 1)
___ Score 3 (≥8 mitoses per mm2) (see Table 1)
___ Only microinvasion present (not graded)
___ No residual invasive carcinoma after presurgical (neoadjuvant) therapy ___ Score cannot be determined
+ Number of mitoses per 10 high-power fields: ___
+ Diameter of microscope field: ___ mm
Overall Grade
___ Grade 1 (scores of 3, 4, or 5)
___ Grade 2 (scores of 6 or 7)
___ Grade 3 (scores of 8 or 9)
___ Only microinvasion present (not graded)
___ No residual invasive carcinoma after presurgical (neoadjuvant) therapy
___ Score cannot be determined
A graduação é feita sempre do maior foco de invasão, mas se focos diferentes tem graduações distintas, o patologista deve reportar isso em separado no laudo anátomo-patológico.
A presença de infiltrado inflamatório intra/peritumoral é objeto de estudos e costuma ser relacionada a um melhor prognóstico por indicar a possibilidade de resposta imune do organismo às células neoplásicas o que poderia acarretar na eliminação destas células. Estudos também avaliam o uso crescente da imunoterapia no tratamento do câncer de mama (4).
Outro fator prognóstico de suma importância é o exame imuno-histoquímico. Estudos atuais recomendam que a avaliação imuno-histoquímica deve ser feita no melhor material disponível, ou seja, aquele que respeitou o tempo de isquemia fria (máximo de 1hora), o tempo total de fixação entre 6 e 72 horas em formol tamponado, que tenha pouco ou nenhum artefato e que represente adequadamente a neoplasia. Em geral opta-se por realizar este estudo no material da biópsia com agulha grossa (“core-biopsy”) pois é o material que em geral respeita estes critérios, em especial o tempo de fixação.
O laudo do estudo imuno-histoquímico também segue padrões bem definidos pelo CAP (5):
Para os receptores de estrogênio e progesterona, os critério são indênticos e abaixo está transcrito como exemplo, o receptor de estrogênio.
Estrogen Receptor (ER) Status (Note A)
___ Positive
Percentage of cells with nuclear positivity# Specify: ___ %
-OR-
Range (Note A)
___ 1-10% (specify): ____ %#
___ 11-20%
___ 21-30%
___ 31-40%
___ 41-50%
___ 51-60%
___ 61-70%
___ 71-80%
___ 81-90%
___ 91-100%
+ Average intensity of staining: + ___ Weak
+ ___ Moderate
+ ___ Strong
___ Negative
___ Internal control cells present and stain as expected ___ Internal control cells absent##
___ Other (specify): __________________________
___ Cannot be determined (indeterminate)###
___ Internal control cells present; no immunoreactivity of either tumor cells or internal controls ___ Other (specify): __________________________
As maiores dificuldades no estudo imuno-histoquímico são encontradas na avaliação do Ki 67 e do HER-2.
O laudo do Ki 67 é feito através de uma estimativa da porcentagem do número de núcleos corados (é um marcador nuclear). Tal estimativa é feita pelo patologista (observador dependente) ou utilizando-se um programa de computador que fará a contagem através da análise de imagem.
Inúmeros estudos foram e são feitos na tentativa de uniformizar o resultado deste marcador de proliferação celular, entretanto ainda não há tal uniformização (6).
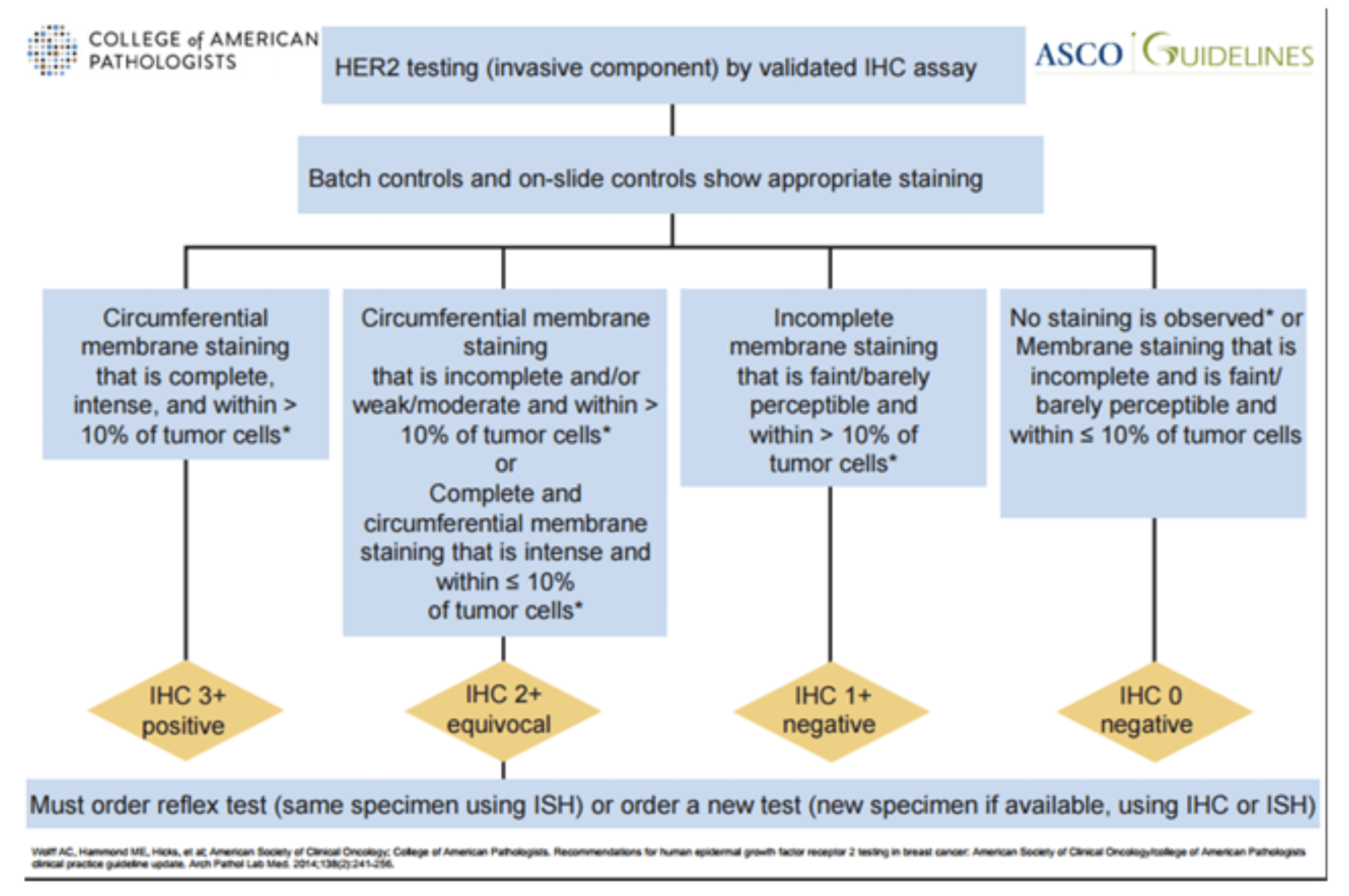
O HER-2 é um marcador prognóstico imuno-histoquímico de suma importância e que tem inúmeros estudos em andamento. Em 2013 a ASCO (Associação Americana de Oncologia Clínica) e o CAP fizeram um novo protocolo para a avaliação do HER-2 tanto por imuno-histoquímica quanto por Hibridização “In situ” (FISCH/CISH). Ainda em 2015 um novo update foi realizado para atualizar os critérios para o HER-2 2+ (duvidoso) (7, 8, 9 e 16).
Abaixo, esquema com os critérios atualizados:
Outro fator prognóstico avaliado e discutido é a presença de invasão perineural. No carcinoma de mama, assim como em outros carcinomas já bem documentados (próstata, cabeça e pescoço), a presença de infiltração perineural é um fator de risco para recorrência local (10).
A partir do estudo imuno-histoquímico também é possível obter a classificação molecular do câncer de mama, conforme tabela abaixo:
Entre os subtipos especiais de câncer invasivo da mama, podemos relacionar alguns (1 e 2):
- Carcinoma lobular (variantes clássica, pleomórfica, alveolar).
- Carcinoma misto (ductal com achados lobulares).
- Carcinoma mucinoso (coloide).
- Carcinoma tubular.
- Carcinoma com achados cribriformes.
- Carcinoma micropapilar.
- Carcinoma papilar.
- Carcinoma medular.
- Carcinoma metaplásico.
- Carcinossarcaoma.
- Carcinoma adenoide cístico, entre outros.
Outros fatores prognósticos incluem:
- Multicentricidade: dois focos neoplásicos com 5cm ou mais de distância entre um foco e outro.
- 2. Multifocalidade: quando os focos neoplásicos estão a uma distância inferior a 5cm.
A presença de neoplasia multifocal/multicêntrica tem importância prognóstica pelo risco aumentado de recidiva local (11, 12).
Avaliação imuno-histoquímica dos casos de neoplasias multicêntricas/multifocais: conforme explicado pela Dra. Daniella, a literatura só recomenda a avaliação imuno-histoquímica de mais de um foco neoplásico naquelas situações em que os fenótipos tumorais são distintos, por exemplo: um foco de carcinoma coloide/mucinoso e outro de carcinoma lobular ou quando o graduação entre os focos for diferente, por exemplo: um foco bem diferenciado e outro pouco diferenciado (13).
Dentre os subtipos especiais de câncer de mama os carcinomas metaplásicos costumam ser neoplasias de alto grau (histológico, nuclear e de índice mitótico). Entre os demais subtipos especiais em geral, a avaliação prognóstica acompanha os ítens das neoplasias ditas “não especiais” (14).
A avaliação transoperatória de linfonodo “sentinela” é um procedimento rotineiro e cientificamente comprovado como sendo eficaz para a avaliação prognóstica e para a tomada de decisão cirúrgica (esvaziamento axilar ou não) (15).
Conforme explicado, atualmente o exame transoperatório (“congelação”) consiste em um exame citológico (“imprint" + raspado), uma vez que os estudos mostraram que o uso do criostato está contraindicado pois o ato de congelar o material provoca alterações artefatuais que podem limitar ou mesmo impedir a análise adequada da amostra bem como o desgaste do material também pode influenciar no resultado podendo levar a falsos-negativos.
Os resultados possíveis em uma exame transoperatório são: positivo para células neoplásicas/negativo para células neoplásicas/aguardar parafina. Eventualmente, em especial mas não só nos casos de carcinoma lobular invasivo da mama, o patologista pode ter muita dificuldade em liberar um resultado conclusivo e nestes casos, pode ser necessário que se aguarde a confecção de lâminas após inclusão em parafina para o diagnóstico definitivo (17).
Após a inclusão em parafina, a análise dos cortes do linfonodo “sentinela" pode ter os seguintes resultados:
- NEGATIVO PARA MALIGNIDADE (AUSENTE METÁSTASE).
CÉLULAS NEOPLÁSICAS ISOLADAS: células isoladas ou pequenos grupamentos de células não maiores do 0,2mm e não mais do que 200 células (NUNCA ENTRA NA CONTAGEM TOTAL DE LINFONODOS COMPROMETIDOS)
- MICROMETÁSTASE: grupamento mais do 0,2mm e menor do que 2mm ou mais do que 200 células. Se único pN1(mi), se junto com macrometástase, entra na contagem total de linfonodos comprometidos
- MACROMETÁSTASE
Dr. Gianfranco Luigi Colombeli
Patologista
CRM-SC 10137. RQE 6702
Ref.:
- JAMA. 2015 Mar 17;313(11):1122-32.
- Tumour Biol. 2017 Apr;39(4):1010428317695023.
- Pathology. 2017 Feb;49(2):166-171.
- Int J Clin Exp Pathol. 2015; 8(9): 9772–9781.
- Int J Surg Pathol. 2017 Jun;25(4):298-303.
- Brachytherapy. 2017 May - Jun;16(3):552-564.
- Am J Clin Pathol. 2015 Dec;144(6):952-9.
- Oncotarget. 2016 Jun 21;7(25):38864-38875.
- J Breast Health (2013). 2016 Apr 1;12(2):78-82.
- PLoS One. 2015; 10(10): e0140652.
- J Oncol Pract. 2017 Mar;13(3):196-198.
Resumo Reunião Científica - Indicações de Radioterapia Pós Mastectomia
Reunião científica Sociedade Brasileira de Mastologia – Regional Santa Catarina
Palestrante:
Dr. Felipe Quintino Kuhnen
Indicações de Radioterapia Pós Mastectomia
A indicação de radioterapia pós mastectomia tornou-se assunto controverso após uma série de publicações mostrando que, diferente do Guideline da ASCO de 2001, onde definiu se que o critério para sua indicação seriam tumores T3 e T4, margens positivas, mais de 3 linfonodos comprometidos no esvaziamento axilar, a indicação poderia se estender também para condições onde a mastectomia foi realizada e foram encontrados de 1-3 linfonodos comprometidos, com benefício de redução dos índices de recorrência loco-regional e aumento sobrevida.
Em 2014 foi publicado no Lancet importante metanálise realizada pelo EBCTCG mostrando índices de RL muito superiores aos encontrados até então em grupo de pacientes com 1-3 linfonodos positivos que foram submetidas mastectomia sem posterior radioterapia complementar.
Com base nestes achados oncologistas, radioterapeutas e cirurgiões, representando a ASCO/ASTRO/SSO realizaram revisão sistemática de importantes publicações recentes e elaboraram novo guideline publicado no Journal of Clinical Oncology em novembro de 2016.
O Guideline atual da ASTRO/ASCO/SSO elucida 4 questões controversas:
1) A radioterapia pós mastectomia (PMRT) está indicada em doentes com tumores T1-2 com um a três linfonodos axilares positivos com dissecção dos linfonodos axilares ?
2) A PMRT está indicada em pacientes com tumores T1-2 e uma biópsia de linfonodo sentinela positiva que não se submetem à dissecção axilar ?
3)A PMRT está indicada em pacientes com câncer de Estágio I ou II que receberam terapia sistêmica neoadjuvante?
4)A irradiação nodal regional deve incluir os linfonodos mamários internos e/ou supraclavicular quando a PMRT é utilizada em pacientes com tumores T1-2 com um a três linfonodos axilares positivos?
Foram discutidos 4 casos clínicos baseados nessas questões e apresentado a conclusão do consenso para cada uma das questões:
1) Há evidência suficiente mostrando que a PMRT reduz o risco de recorrência loco-regional, recorrência a distância e mortalidade por câncer de mama em pacientes T1-2 com 1 a 3 linfonodos positivos. Entretanto, um grupo de pacientes podem ter um risco baixo de recorrência na qual o benefício da PMRT seria menor que o risco de potencial toxicidade (tumores T1, baixo grau, idade maior 45, receptores hormonais positivos, somente 1 linfonodo positivo) . Entretanto o painel não achou evidência científica suficiente para endossar um grupo específico de pacientes no qual a PMT não deveria ser administrada.
2) Não é apropriado a submeter as pacientes à potenciais toxicidades agudas e tardias da PMRT sem uma cuidadosa comparação com o esvaziamento axilar. Recomenda que essas pacientes recebam PMRT apenas se houver informação suficiente que radioterapia é necessária sem a necessidade de saber se outros linfonodos axilares estão comprometidos. Em outras palavras, naquela situação onde a radioterapia tenha indicação baseada em outros índices prognósticos além do comprometimento ganglionar, o esvaziamento poderia ser dispensado e a axila seria tratada pela radioterapia.
3) Pacientes com axila positiva após QT neoadjuvante devem receber PMRT. Dados observacionais sugerem baixo risco de recidiva loco-regional em pacientes com axila negativa que recebem QT neoadjuvante ou com resposta completa nos linfonodos. Entretanto não há evidência suficiente que a PMRT deva ser omitida neste grupo de pacientes.
4)Os volumes alvo mínimos obrigatórios para PMRT são a parede torácica e os nós apiculares axilares e supraclaviculares.Continua a haver controvérsia sobre quando os linfonodos da mamária interna e os linfonodos axilares de nível I e II se devem ser deliberadamente incluídos. Pode haver subgrupos que não se beneficiem de tratar ambas as áreas nodais em comparação com o tratamento de apenas a parede torácica ou a mama reconstruída ou uma área de drenagem. Tratamento da fossa supraclavicular e da mamária interna pode resultar em toxicidade adicional, com morbidade cardíaca e pulmonar, mesmo com técnicas avançadas de radioterapia.
Novos estudos estão em andamento com objetivo de analisar a necessidade de radioterapia em doença inicial ou em pacientes com resposta completa após neoadjuvância. Até este momento este guideline é a linha mais segura para avaliação do tratamento radioterápico complementar.
Dr. Felipe Quintino Kuhnen
CRM/SC 11859
Radio Oncologista do Imperial Hospital de Caridade
Radio Oncologista do Cepon
Radio Oncologista do Hospital São José - Criciúma