Resumo Reunião Científica - Cirurgias redutoras de risco – Quando indicar?
Reunião científica Sociedade Brasileira de Mastologia - Regional Santa Catarina
Palestrante:
Dra Juliana Koerich Laureano
Mastologista | Prefeitura do Município de Florianópolis, CEPON e Clinifemina
Debatedores:
Dra. Cristiane Fabiani
Dr. Erik Paul Winnikow
Dra. Pricila Bernardi
Cirurgias redutoras de risco – Quando indicar?
Resumo Completo: GEMA Cirurgias Redutoras de Risco
Dra Juliana Koerich Laureano
CRM/SC 16755 / RQE:14054
Mastologista | Prefeitura do Município de Florianópolis, CEPON e Clinifemina
Resumo Reunião Científica - Biópsias de mama: Quando indicar? Qual técnica escolher?
Reunião científica Sociedade Brasileira de Mastologia - Regional Santa Catarina
Palestrante:
Dra Luciane Stüpp de Freitas - médica radiologista CEPON - Florianópolis - SC
Debatedores:
Dra Cristina Gaspar Salvador Tavares - médica radiologista clínica Sonitec - Florianópolis - SC
Dr Fernando Vequi Martins - médico mastologista clínica Le Santé - Lages - SC
Dr João Péricles da silva Jr. - médico patologista Hospital Universitárioio/UFSC e clínica IAP
Biópsias de mama: Quando indicar? Qual técnica escolher?
Métodos de Biópsias guiados por imagem
1) Punção Aspirativa por Agulha Fina (PAAF)
A PAAF é um procedimento simples, com baixas taxas de complicações e de baixo custo, podendo ser realizado facilmente em serviços de imagem. Entretanto necessita de indicações precisas e técnica adequada para se tentar evitar a amostragem insuficiente ao patologista e principalmente evitar falsos negativos. A presença do patologista em sala durante o procedimento reduz sensivelmente as amostras insuficientes e deve ser considerada sempre que possível.
Sabe-se que a sensibilidade da PAAF é menor em relação à da core biópsia (74% e 87%, respectivamente), porém suas especificidades são semelhantes (98% e 96%, respectivamente)8, o que pode ser útil quando se necessita de um diagnóstico rápido para a paciente.
A PAAF apresenta, entretanto, limitações importantes que interferem diretamente na conduta clínica, dentre as principais, a incapacidade da avaliação de receptores hormonais, a dificuldade na distinção de lesões invasivas e não invasivas, bem como a subestimação entre hiperplasia ductal atípica (HDA) e carcinoma ductal in situ (CDIS), além de ser incapaz de determinar a natureza benigna das calcificações4.
Desta forma é consensual na maioria dos artigos revisados algumas indicações específicas para PAAF, tais quais: esvaziamento de cistos, avaliação de linfonodo axilar em paciente com diagnóstico estabelecido de malignidade, bem como a necessidade de realização de diagnóstico rápido para lesão de alta suspeita como BI-RADS 5 ou lesões no leito da mastectomia.
Outras indicações que se pode consideradar a PAAF são lesões com baixa probabilidade de malignidade (BI-RADS 3) e lesões de difícil acesso com agulha mais calibrosa, como aquelas localizadas junto à parede torácica, bem como algumas limitações clínicas relacionadas à paciente e a intolerância aos outros procedimentos.
As contraindicações de PAAF formais são calcificações e áreas suspeitas para lesão esclerosante complexa (cicatriz radiada) ou carcinoma lobular invasor (CLI), estas últimas representadas por distorção arquitetural ou assimetria à mamografia.
Sabe-se que lesões maiores apresentam maior heterogeneidade na lesão, o que pode determinar menor sensibilidade da PAAF, sendo sugerido nestes casos evitar a PAAF e preferir a realização de biópsia por fragmento.
2) Biópsia por fragmento – core biópsia (CB)
É bem estabelecido que quanto maior o tamanho do fragmento (agulha), melhor a acurácia diagnóstica4, sendo observados na prática clínica bons resultados com a agulha de 14 Gauge (G). Entretanto, quando as lesões são muito pequenas ou mesmo nos linfonodos axilares, pode-se optar pela utilização de agulha de 16 G com a colocação de clipe de marcação da lesão, tanto na ultrassonografia quanto na mamografia.
O risco de subestimação dos achados da CB também pode ocorrer e deve-se ater principalmente a lesões com achado de HDA, que pode estar associada a CDIS ou mesmo carcinoma ductal invasor (CDI) entre 16% e 55% dos casos4. Os achados de cicatriz radial, lesões papilíferas, carcinoma lobular in situ (CLIS) e tumor filoide também podem ser subestimados e a necessidade de estrita correlação radiológica e patológica é fundamental na determinação destes casos, a fim de restringir ou não a indicação cirúrgica.
Dentro dos aspectos observados, a CB apresenta como principal indicação a avaliação de nódulos sólidos, com maior especificidade em lesões maiores em relação a PAAF, especialmente pela característica heterogênea destes nódulos, possibilitando a aquisição de maior quantidade de material em diferentes áreas da lesão. Além disso, calcificações, áreas de distorção arquitetural e assimetrias focais necessitam de maior amostragem de material para o diagnóstico adequado devido ao padrão histológico heterogêneo destes achados.
As contraindicações da CB estão relacionadas a contraindicações clínicas da paciente, devendo-se levar em consideração na escolha do método as principais vantagens e desvantagens, bastante enumeradas em diferentes estudos e revisões, sendo consenso entre as vantagens a possibilidade de avaliação do perfil hormonal das lesões, confirmação de lesão invasiva, boa distinção entre fibroadenoma e tumor filodes, boa correlação em lesões pequenas (< 1,0 cm e > 4,0 cm)10. Dentre as desvantagens podem ser consideradas o difícil acesso a lesões profundas, lesões papilíferas, necessidade de entrar e sair da mama com a agulha várias vezes, maior custo e tempo em relação à PAAF.
3) Biópsia assistida à vácuo BAV (mamotomia®)
Baseado no conceito em que o maior fragmento fornece o melhor diagnóstico, a BAV apresenta esta relação como principal diferencial, podendo chegar a uma acurácia diagnóstica de até 99%3, com menor subestimação de resultados e menor taxa de rebióspia4. A agulha calibrosa (de 7 a 12G) e aspiração à vácuo facilitam a aquisição dos fragmentos, sem a necessidade de retirada da agulha de dentro da mama, o que reduz a possibilidade de hematoma, o tempo de procedimento e também a chance de possíveis lesões cicatriciais no parênquima ou deslocamento de células epiteliais que possam simular invasão. Além disso, a BAV tem a possibilidade de realizar a excisão completa da lesão, o que no caso de lesões benignas é terapêutica, haja vista a boa concordância nos estudos clínicos com os achados de cirurgia.
As indicações são semelhantes às da CB, sendo mais bem indicada nos casos de calcificações, lesões pequenas (< 0,5 cm 3), lesões intraductais, lesões difusas ou inespecíficas, assimetrias ou alteração arquitetural e para retirada de lesões benignas (fibroadenoma/fibroadenoma like, cicatriz radial, lesões papilíferas). A clipagem do local abordado ocorre de rotina em lesões menores para posterior localização ou nos casos de pacientes a serem submetidas a quimioterapia neoadjuvantes, em que pode haver resposta completa.
Além disso é o único método possível de se utilizar quando é necessário guiar o procedimento por ressonância magnética.
A principal desvantagem da BAV é o alto custo do procedimento e baixa disponibilidade (grandes centros).
Qual método escolher?
Baseado na descrição acima, a escolha da técnica a ser utilizada, bem como o método de imagem para guiar o procedimento vai depender do aspecto da lesão e do potencial de malignidade esperado para tal. Fatores que precisam ser considerados envolvem o tamanho da lesão, as características clínicas e de imagem, a experiência do radiologista e do patologista, a necessidade de quimioterapia neoadjuvante ou de um resultado rápido e a tolerância da paciente ao procedimento.
E depois?
A determinação da concordância dos dados de imagem com o achado anatomopatológico é fundamental devido a heterogeneidade das lesões da mama, para enfim determinar a conduta final a ser adotada. Esta correlação final permite evitar a “perda” diagnóstica de falsos negativos e assim impedir o atraso no diagnóstico de câncer, sendo que o radiologista que realizou o procedimento o responsável pela correlação5, não se devendo excluir a interação com o médico assistente e com o patologista para finalização do caso.
Nos casos de lesões benignas concordantes não há uma normativa em como fazer o controle destas lesões e cada serviço determina a conduta a ser seguida, baseada nos diferentes estudos correlatos. Dentre as sugestões em diferentes estudos, as condutas de um controle em 6 meses ou controle semelhante a um achado BI-RADS®3 (6, 12 e 24 meses) são as mais adotadas nos principais serviços.
Conclusão:
Tanto a CB quanto a PAAF são modalidades de diagnóstico comuns e facilmente acessíveis no nosso meio e ambas apresentam limitações e vantagens. Porém diante do que se tem de conhecimento destes procedimentos recomenda-se preferir a CB a PAAF nas lesões de mama12,8.
A BAV deve ser considerada em casos específicos e ponderada devido ao alto custo de sua realização.
O quadro abaixo (adaptado4) mostra os diferentes métodos e suas principais indicações de uma maneira resumida:
| Lesão | PAAF | CORE | BAV |
| Nódulo | +
(> 1,0 cm - < 4,0 cm) |
+++ | +
(< 0,5 cm) |
| Calcificação | N/A | + | +++ |
| Assimetria focal ou Alteração arquitetural | N/A | + | +++ |
| Linfonodo axilar | +++ | + |
Cada serviço precisa adequar-se a sua realidade, procurar seguir as recomendações formais, porém dentro das suas limitações existentes fazer o possível para fornecer o melhor para cada paciente e consequentemente ter os melhores resultados e também a realização profissional.
Apêndice:
Linfonodos axilares
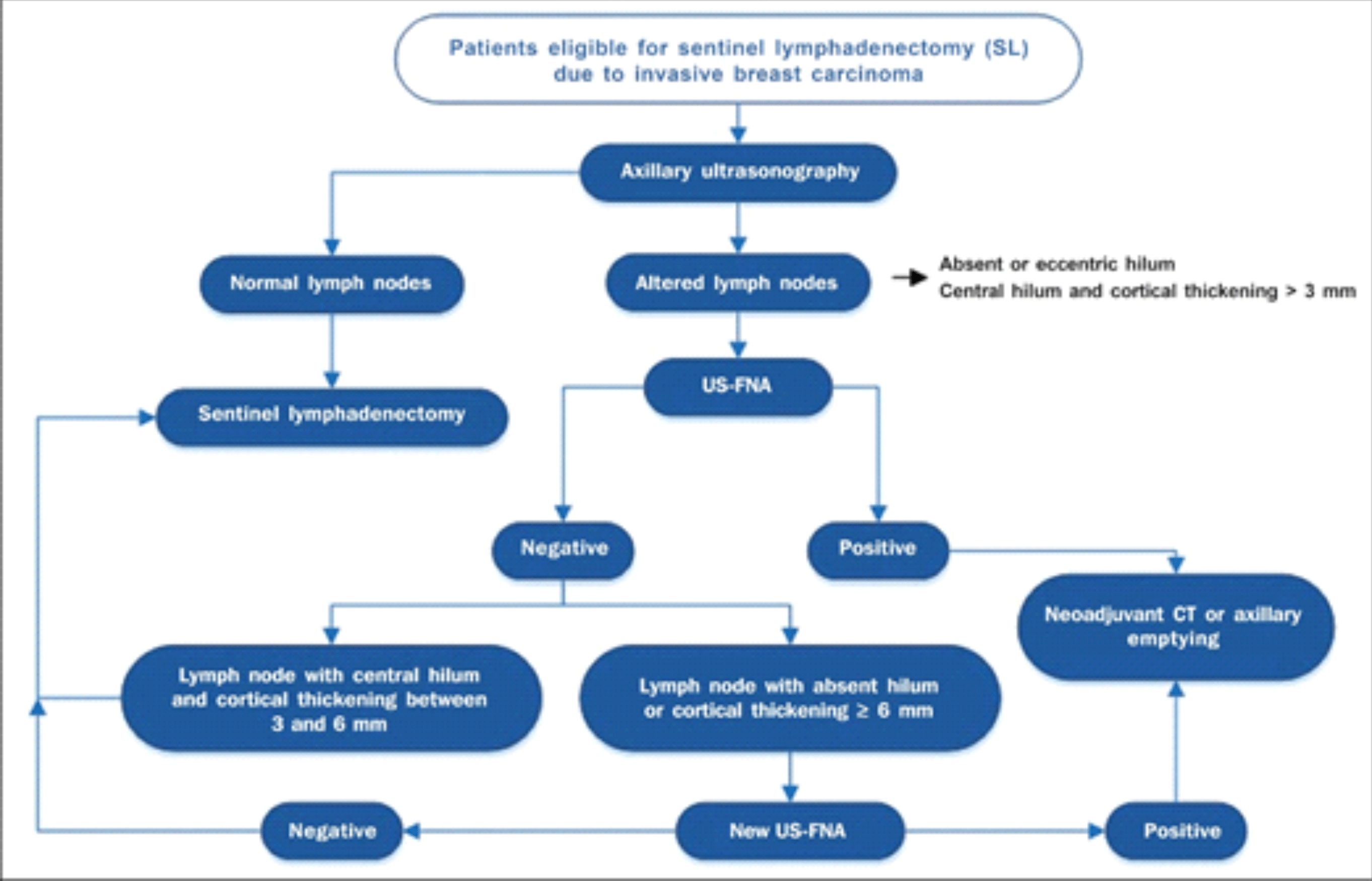
A avaliação da axila clinicamente negativa pode ser feita de maneira satisfatória pela ultrassonografia e os critérios ultrassonográficos de anormalidade mostram boa correlação com os achados da biópsia do linfonodo sentinela.
A PAAF pode ser considerada adicionalmente nos casos de ultrassonografia suspeita, porém o resultado negativo da PAAF não exclui a presença de metástase linfonodal e embora alguns dos conceitos a respeito da abordagem axilar venham se modificando a partir do estudo Z0011 – American College of Surgeons Oncology Group, habitualmente a pesquisa intraoperatória do linfonodo sentinela ainda é realizada. Uma alternativa à PAAF é a bióspia por agulha grossa (18 ou 16G), que apresenta maior acurácia, porém requer maior experiência do examinador e dispende de maior custo.
Desta forma alguns critérios merecem ser considerados na definição da doença nodal, havendo consenso na maior parte dos estudos revisados que o tamanho dos gânglios não deve ser considerado como critério para avaliação anatomopatológica. Os achados morfológicos, no entanto, são os principais requisitos para a decisão da investigação destes linfonodos, incluindo forma, espessamento cortical, estrutura do hilo e ecogencidade16. Para os casos de espessamento irregular da cortical, uma espessura maior que 3 mm já pode ser considerada suficiente para determinar a avaliação cito/histológica de estadiamento pré-operatório.
Dentro desta premissa, Rocha et al.17 propõe um algoritmo de avaliação axilar a partir da utilização inicial da ultrassonografia e seus critérios de inclusão para a realização da PAAF pré-operatória (anexo).
Anexo:
Algoritmo para a utilização da ultrassonografia axilar e da punção aspirativa por agulha fina (PAAF-US) na avaliação pré-operatória de pacientes com câncer de mama invasivo17.
Revisão bibliográfica:
- DOI 10.1053/crad.2001.0875 - Clinical Radiology 2002
- DOI 10.1002/dc.21433 - Diagnostic Cytopathology 2010
- DOI 10.1007/978-3-540-31611-4_2 - Recent Results in Cancer Research 2009
- DOI 10.1016/j.crad.2010.01.008 - Clinical Radiology 2010
- DOI 10.3348/kjr.2011.12.2.232 - Korean J Radiol 2011
- DOI 10.1016/j.rcl.2007.06.010 - Radiol Clin N Am 2007
- DOI 10.1148/radiol.13120985/-/DC1 - Radiology 2013
- DOI http://dx.doi.org/10.1016/j.breast.2016.11.009 - The Breast 2017
- DOI 10.1148/rg.2017160117 - Radiographics 2017
- DOI 10.1136/jclinpath-2011-200410 - J Clin Pathol 2012
- DOI 10.1007/s10549-010-0962-4 - Breast Cancer Res Treat 2010
- DOI http://dx.doi.org/10.1016/j.breast.2016.09.009 - The Breast 2016
- DOI 10.1111/his.12852 - Histopathology 2016
- DOI http://dx.doi.org/10.1590/0100-3984.2014.0110 - Radiol Bras 2016
- DOI 10.1001/jama.2015.1405 – JAMA 2015
- DOI 2214/AJR.16.16545 – AJR 2016
- DOI http://dx.doi.org/10.1590/0100-3984.2014.0121 - Radiol Bras 2015
Dra. Luciane Stüpp de Freitas.
Especialista em Radiologia e Diagnóstico por Imagem
CRM 11627/SC – RQE 10083