Resumo Reunião Científica - Biópsias de mama: Quando indicar? Qual técnica escolher?
Reunião científica Sociedade Brasileira de Mastologia - Regional Santa Catarina
Palestrante:
Dra Luciane Stüpp de Freitas - médica radiologista CEPON - Florianópolis - SC
Debatedores:
Dra Cristina Gaspar Salvador Tavares - médica radiologista clínica Sonitec - Florianópolis - SC
Dr Fernando Vequi Martins - médico mastologista clínica Le Santé - Lages - SC
Dr João Péricles da silva Jr. - médico patologista Hospital Universitárioio/UFSC e clínica IAP
Biópsias de mama: Quando indicar? Qual técnica escolher?
Métodos de Biópsias guiados por imagem
1) Punção Aspirativa por Agulha Fina (PAAF)
A PAAF é um procedimento simples, com baixas taxas de complicações e de baixo custo, podendo ser realizado facilmente em serviços de imagem. Entretanto necessita de indicações precisas e técnica adequada para se tentar evitar a amostragem insuficiente ao patologista e principalmente evitar falsos negativos. A presença do patologista em sala durante o procedimento reduz sensivelmente as amostras insuficientes e deve ser considerada sempre que possível.
Sabe-se que a sensibilidade da PAAF é menor em relação à da core biópsia (74% e 87%, respectivamente), porém suas especificidades são semelhantes (98% e 96%, respectivamente)8, o que pode ser útil quando se necessita de um diagnóstico rápido para a paciente.
A PAAF apresenta, entretanto, limitações importantes que interferem diretamente na conduta clínica, dentre as principais, a incapacidade da avaliação de receptores hormonais, a dificuldade na distinção de lesões invasivas e não invasivas, bem como a subestimação entre hiperplasia ductal atípica (HDA) e carcinoma ductal in situ (CDIS), além de ser incapaz de determinar a natureza benigna das calcificações4.
Desta forma é consensual na maioria dos artigos revisados algumas indicações específicas para PAAF, tais quais: esvaziamento de cistos, avaliação de linfonodo axilar em paciente com diagnóstico estabelecido de malignidade, bem como a necessidade de realização de diagnóstico rápido para lesão de alta suspeita como BI-RADS 5 ou lesões no leito da mastectomia.
Outras indicações que se pode consideradar a PAAF são lesões com baixa probabilidade de malignidade (BI-RADS 3) e lesões de difícil acesso com agulha mais calibrosa, como aquelas localizadas junto à parede torácica, bem como algumas limitações clínicas relacionadas à paciente e a intolerância aos outros procedimentos.
As contraindicações de PAAF formais são calcificações e áreas suspeitas para lesão esclerosante complexa (cicatriz radiada) ou carcinoma lobular invasor (CLI), estas últimas representadas por distorção arquitetural ou assimetria à mamografia.
Sabe-se que lesões maiores apresentam maior heterogeneidade na lesão, o que pode determinar menor sensibilidade da PAAF, sendo sugerido nestes casos evitar a PAAF e preferir a realização de biópsia por fragmento.
2) Biópsia por fragmento – core biópsia (CB)
É bem estabelecido que quanto maior o tamanho do fragmento (agulha), melhor a acurácia diagnóstica4, sendo observados na prática clínica bons resultados com a agulha de 14 Gauge (G). Entretanto, quando as lesões são muito pequenas ou mesmo nos linfonodos axilares, pode-se optar pela utilização de agulha de 16 G com a colocação de clipe de marcação da lesão, tanto na ultrassonografia quanto na mamografia.
O risco de subestimação dos achados da CB também pode ocorrer e deve-se ater principalmente a lesões com achado de HDA, que pode estar associada a CDIS ou mesmo carcinoma ductal invasor (CDI) entre 16% e 55% dos casos4. Os achados de cicatriz radial, lesões papilíferas, carcinoma lobular in situ (CLIS) e tumor filoide também podem ser subestimados e a necessidade de estrita correlação radiológica e patológica é fundamental na determinação destes casos, a fim de restringir ou não a indicação cirúrgica.
Dentro dos aspectos observados, a CB apresenta como principal indicação a avaliação de nódulos sólidos, com maior especificidade em lesões maiores em relação a PAAF, especialmente pela característica heterogênea destes nódulos, possibilitando a aquisição de maior quantidade de material em diferentes áreas da lesão. Além disso, calcificações, áreas de distorção arquitetural e assimetrias focais necessitam de maior amostragem de material para o diagnóstico adequado devido ao padrão histológico heterogêneo destes achados.
As contraindicações da CB estão relacionadas a contraindicações clínicas da paciente, devendo-se levar em consideração na escolha do método as principais vantagens e desvantagens, bastante enumeradas em diferentes estudos e revisões, sendo consenso entre as vantagens a possibilidade de avaliação do perfil hormonal das lesões, confirmação de lesão invasiva, boa distinção entre fibroadenoma e tumor filodes, boa correlação em lesões pequenas (< 1,0 cm e > 4,0 cm)10. Dentre as desvantagens podem ser consideradas o difícil acesso a lesões profundas, lesões papilíferas, necessidade de entrar e sair da mama com a agulha várias vezes, maior custo e tempo em relação à PAAF.
3) Biópsia assistida à vácuo BAV (mamotomia®)
Baseado no conceito em que o maior fragmento fornece o melhor diagnóstico, a BAV apresenta esta relação como principal diferencial, podendo chegar a uma acurácia diagnóstica de até 99%3, com menor subestimação de resultados e menor taxa de rebióspia4. A agulha calibrosa (de 7 a 12G) e aspiração à vácuo facilitam a aquisição dos fragmentos, sem a necessidade de retirada da agulha de dentro da mama, o que reduz a possibilidade de hematoma, o tempo de procedimento e também a chance de possíveis lesões cicatriciais no parênquima ou deslocamento de células epiteliais que possam simular invasão. Além disso, a BAV tem a possibilidade de realizar a excisão completa da lesão, o que no caso de lesões benignas é terapêutica, haja vista a boa concordância nos estudos clínicos com os achados de cirurgia.
As indicações são semelhantes às da CB, sendo mais bem indicada nos casos de calcificações, lesões pequenas (< 0,5 cm 3), lesões intraductais, lesões difusas ou inespecíficas, assimetrias ou alteração arquitetural e para retirada de lesões benignas (fibroadenoma/fibroadenoma like, cicatriz radial, lesões papilíferas). A clipagem do local abordado ocorre de rotina em lesões menores para posterior localização ou nos casos de pacientes a serem submetidas a quimioterapia neoadjuvantes, em que pode haver resposta completa.
Além disso é o único método possível de se utilizar quando é necessário guiar o procedimento por ressonância magnética.
A principal desvantagem da BAV é o alto custo do procedimento e baixa disponibilidade (grandes centros).
Qual método escolher?
Baseado na descrição acima, a escolha da técnica a ser utilizada, bem como o método de imagem para guiar o procedimento vai depender do aspecto da lesão e do potencial de malignidade esperado para tal. Fatores que precisam ser considerados envolvem o tamanho da lesão, as características clínicas e de imagem, a experiência do radiologista e do patologista, a necessidade de quimioterapia neoadjuvante ou de um resultado rápido e a tolerância da paciente ao procedimento.
E depois?
A determinação da concordância dos dados de imagem com o achado anatomopatológico é fundamental devido a heterogeneidade das lesões da mama, para enfim determinar a conduta final a ser adotada. Esta correlação final permite evitar a “perda” diagnóstica de falsos negativos e assim impedir o atraso no diagnóstico de câncer, sendo que o radiologista que realizou o procedimento o responsável pela correlação5, não se devendo excluir a interação com o médico assistente e com o patologista para finalização do caso.
Nos casos de lesões benignas concordantes não há uma normativa em como fazer o controle destas lesões e cada serviço determina a conduta a ser seguida, baseada nos diferentes estudos correlatos. Dentre as sugestões em diferentes estudos, as condutas de um controle em 6 meses ou controle semelhante a um achado BI-RADS®3 (6, 12 e 24 meses) são as mais adotadas nos principais serviços.
Conclusão:
Tanto a CB quanto a PAAF são modalidades de diagnóstico comuns e facilmente acessíveis no nosso meio e ambas apresentam limitações e vantagens. Porém diante do que se tem de conhecimento destes procedimentos recomenda-se preferir a CB a PAAF nas lesões de mama12,8.
A BAV deve ser considerada em casos específicos e ponderada devido ao alto custo de sua realização.
O quadro abaixo (adaptado4) mostra os diferentes métodos e suas principais indicações de uma maneira resumida:
| Lesão | PAAF | CORE | BAV |
| Nódulo | +
(> 1,0 cm - < 4,0 cm) |
+++ | +
(< 0,5 cm) |
| Calcificação | N/A | + | +++ |
| Assimetria focal ou Alteração arquitetural | N/A | + | +++ |
| Linfonodo axilar | +++ | + |
Cada serviço precisa adequar-se a sua realidade, procurar seguir as recomendações formais, porém dentro das suas limitações existentes fazer o possível para fornecer o melhor para cada paciente e consequentemente ter os melhores resultados e também a realização profissional.
Apêndice:
Linfonodos axilares
A avaliação da axila clinicamente negativa pode ser feita de maneira satisfatória pela ultrassonografia e os critérios ultrassonográficos de anormalidade mostram boa correlação com os achados da biópsia do linfonodo sentinela.
A PAAF pode ser considerada adicionalmente nos casos de ultrassonografia suspeita, porém o resultado negativo da PAAF não exclui a presença de metástase linfonodal e embora alguns dos conceitos a respeito da abordagem axilar venham se modificando a partir do estudo Z0011 – American College of Surgeons Oncology Group, habitualmente a pesquisa intraoperatória do linfonodo sentinela ainda é realizada. Uma alternativa à PAAF é a bióspia por agulha grossa (18 ou 16G), que apresenta maior acurácia, porém requer maior experiência do examinador e dispende de maior custo.
Desta forma alguns critérios merecem ser considerados na definição da doença nodal, havendo consenso na maior parte dos estudos revisados que o tamanho dos gânglios não deve ser considerado como critério para avaliação anatomopatológica. Os achados morfológicos, no entanto, são os principais requisitos para a decisão da investigação destes linfonodos, incluindo forma, espessamento cortical, estrutura do hilo e ecogencidade16. Para os casos de espessamento irregular da cortical, uma espessura maior que 3 mm já pode ser considerada suficiente para determinar a avaliação cito/histológica de estadiamento pré-operatório.
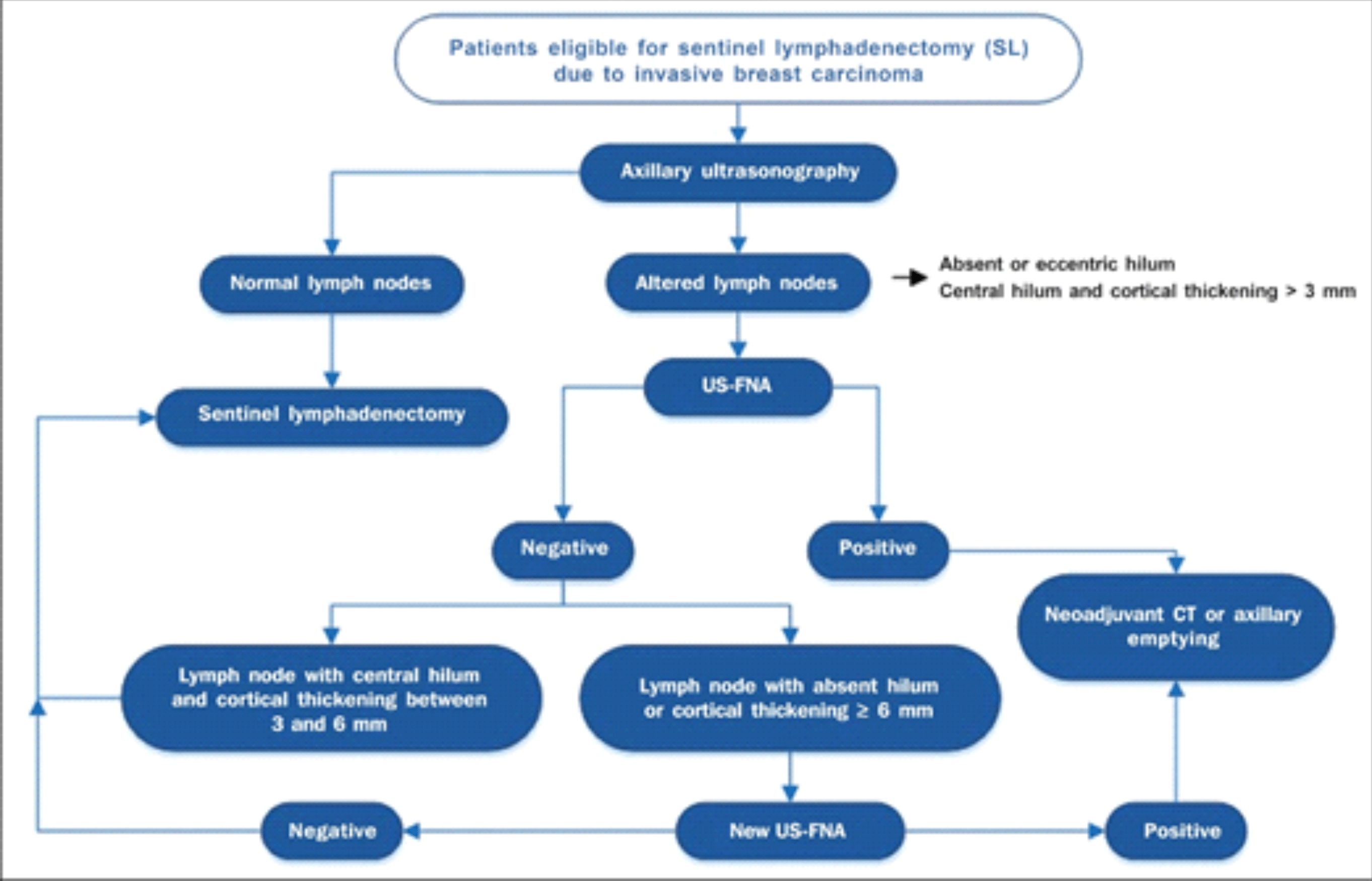
Dentro desta premissa, Rocha et al.17 propõe um algoritmo de avaliação axilar a partir da utilização inicial da ultrassonografia e seus critérios de inclusão para a realização da PAAF pré-operatória (anexo).
Anexo:
Algoritmo para a utilização da ultrassonografia axilar e da punção aspirativa por agulha fina (PAAF-US) na avaliação pré-operatória de pacientes com câncer de mama invasivo17.
Revisão bibliográfica:
- DOI 10.1053/crad.2001.0875 - Clinical Radiology 2002
- DOI 10.1002/dc.21433 - Diagnostic Cytopathology 2010
- DOI 10.1007/978-3-540-31611-4_2 - Recent Results in Cancer Research 2009
- DOI 10.1016/j.crad.2010.01.008 - Clinical Radiology 2010
- DOI 10.3348/kjr.2011.12.2.232 - Korean J Radiol 2011
- DOI 10.1016/j.rcl.2007.06.010 - Radiol Clin N Am 2007
- DOI 10.1148/radiol.13120985/-/DC1 - Radiology 2013
- DOI http://dx.doi.org/10.1016/j.breast.2016.11.009 - The Breast 2017
- DOI 10.1148/rg.2017160117 - Radiographics 2017
- DOI 10.1136/jclinpath-2011-200410 - J Clin Pathol 2012
- DOI 10.1007/s10549-010-0962-4 - Breast Cancer Res Treat 2010
- DOI http://dx.doi.org/10.1016/j.breast.2016.09.009 - The Breast 2016
- DOI 10.1111/his.12852 - Histopathology 2016
- DOI http://dx.doi.org/10.1590/0100-3984.2014.0110 - Radiol Bras 2016
- DOI 10.1001/jama.2015.1405 – JAMA 2015
- DOI 2214/AJR.16.16545 – AJR 2016
- DOI http://dx.doi.org/10.1590/0100-3984.2014.0121 - Radiol Bras 2015
Dra. Luciane Stüpp de Freitas.
Especialista em Radiologia e Diagnóstico por Imagem
CRM 11627/SC – RQE 10083
Resumo Reunião Científica - Índices prognósticos anátomo-patológicos no câncer de mama
Reunião científica Sociedade Brasileira de Mastologia - Regional Santa Catarina
Palestrante:
Dra Dr. Gianfranco Luigi Colombeli
Debatedores:
Dra. Daniella Serafin Couto Vieira,
Dra. Maria Eduarda Meyer,
Dr. Ygor de Oliveira
Índices prognósticos anátomo-patológicos no câncer de mama
Importante citar que o laudo anátomo-patológico, construído na ocasião da avaliação de casos de câncer de mama, costuma seguir as recomendações do Manual de Laudos da Sociedade Brasileira de Patologia e os Protocolos para Laudos Anátomo-Patológicos de Câncer de Mama do Colégio Americano de Patologistas (CAP) (1 e 2).
Um dos itens prognósticos mais importantes é a graduação anátomo-patológica. Tal graduação segue critérios bem estabelecidos, entretanto deve-se lembrar que o câncer de mama é uma neoplasia muito heterogênea e que tal graduação é observador dependente, ou seja, dois patologistas podem fornecer graduações distintas observando a mesma lâmina. Outros fatores também podem influenciar e provocar variações nos laudos, seja de materiais diferentes (biópsia x peça cirúrgica), seja entre diferentes laboratórios/patologistas avaliando o mesmo material/lâmina, tais como: fixação inadequada (autólise), formol não tamponado (imuno-histoquímica inconclusiva ou falso-negativa), uso do cautério (artefatos térmicos que impedem a avaliação adequadas das características celulares, arquiteturais e de margens cirúrgicas), entre outros (3).
Abaixo, os critérios reproduzidos na íntegra do protocolo do CAP (1 e 2).
Glandular (Acinar)/Tubular Differentiation
___ Score 1 (>75% of tumor area forming glandular/tubular structures)
___ Score 2 (10% to 75% of tumor area forming glandular/tubular structures) ___ Score 3 (<10% of tumor area forming glandular/tubular structures)
___ Only microinvasion present (not graded)
___ No residual invasive carcinoma after presurgical (neoadjuvant) therapy ___ Score cannot be determined
Nuclear Pleomorphism
___ Score 1 (nuclei small with little increase in size in comparison with normal breast epithelial cells, regular outlines, uniform nuclear chromatin, little variation in size)
___ Score 2 (cells larger than normal with open vesicular nuclei, visible nucleoli, and moderate variability in both size and shape)
___ Score 3 (vesicular nuclei, often with prominent nucleoli, exhibiting marked variation in size and shape, occasionally with very large and bizarre forms)
___ Only microinvasion present (not graded)
___ No residual invasive carcinoma after presurgical (neoadjuvant) therapy ___ Score cannot be determined
Mitotic Rate
___ Score 1 (≤3 mitoses per mm2) (see Table 1)
___ Score 2 (4-7 mitoses per mm2) (see Table 1)
___ Score 3 (≥8 mitoses per mm2) (see Table 1)
___ Only microinvasion present (not graded)
___ No residual invasive carcinoma after presurgical (neoadjuvant) therapy ___ Score cannot be determined
+ Number of mitoses per 10 high-power fields: ___
+ Diameter of microscope field: ___ mm
Overall Grade
___ Grade 1 (scores of 3, 4, or 5)
___ Grade 2 (scores of 6 or 7)
___ Grade 3 (scores of 8 or 9)
___ Only microinvasion present (not graded)
___ No residual invasive carcinoma after presurgical (neoadjuvant) therapy
___ Score cannot be determined
A graduação é feita sempre do maior foco de invasão, mas se focos diferentes tem graduações distintas, o patologista deve reportar isso em separado no laudo anátomo-patológico.
A presença de infiltrado inflamatório intra/peritumoral é objeto de estudos e costuma ser relacionada a um melhor prognóstico por indicar a possibilidade de resposta imune do organismo às células neoplásicas o que poderia acarretar na eliminação destas células. Estudos também avaliam o uso crescente da imunoterapia no tratamento do câncer de mama (4).
Outro fator prognóstico de suma importância é o exame imuno-histoquímico. Estudos atuais recomendam que a avaliação imuno-histoquímica deve ser feita no melhor material disponível, ou seja, aquele que respeitou o tempo de isquemia fria (máximo de 1hora), o tempo total de fixação entre 6 e 72 horas em formol tamponado, que tenha pouco ou nenhum artefato e que represente adequadamente a neoplasia. Em geral opta-se por realizar este estudo no material da biópsia com agulha grossa (“core-biopsy”) pois é o material que em geral respeita estes critérios, em especial o tempo de fixação.
O laudo do estudo imuno-histoquímico também segue padrões bem definidos pelo CAP (5):
Para os receptores de estrogênio e progesterona, os critério são indênticos e abaixo está transcrito como exemplo, o receptor de estrogênio.
Estrogen Receptor (ER) Status (Note A)
___ Positive
Percentage of cells with nuclear positivity# Specify: ___ %
-OR-
Range (Note A)
___ 1-10% (specify): ____ %#
___ 11-20%
___ 21-30%
___ 31-40%
___ 41-50%
___ 51-60%
___ 61-70%
___ 71-80%
___ 81-90%
___ 91-100%
+ Average intensity of staining: + ___ Weak
+ ___ Moderate
+ ___ Strong
___ Negative
___ Internal control cells present and stain as expected ___ Internal control cells absent##
___ Other (specify): __________________________
___ Cannot be determined (indeterminate)###
___ Internal control cells present; no immunoreactivity of either tumor cells or internal controls ___ Other (specify): __________________________
As maiores dificuldades no estudo imuno-histoquímico são encontradas na avaliação do Ki 67 e do HER-2.
O laudo do Ki 67 é feito através de uma estimativa da porcentagem do número de núcleos corados (é um marcador nuclear). Tal estimativa é feita pelo patologista (observador dependente) ou utilizando-se um programa de computador que fará a contagem através da análise de imagem.
Inúmeros estudos foram e são feitos na tentativa de uniformizar o resultado deste marcador de proliferação celular, entretanto ainda não há tal uniformização (6).
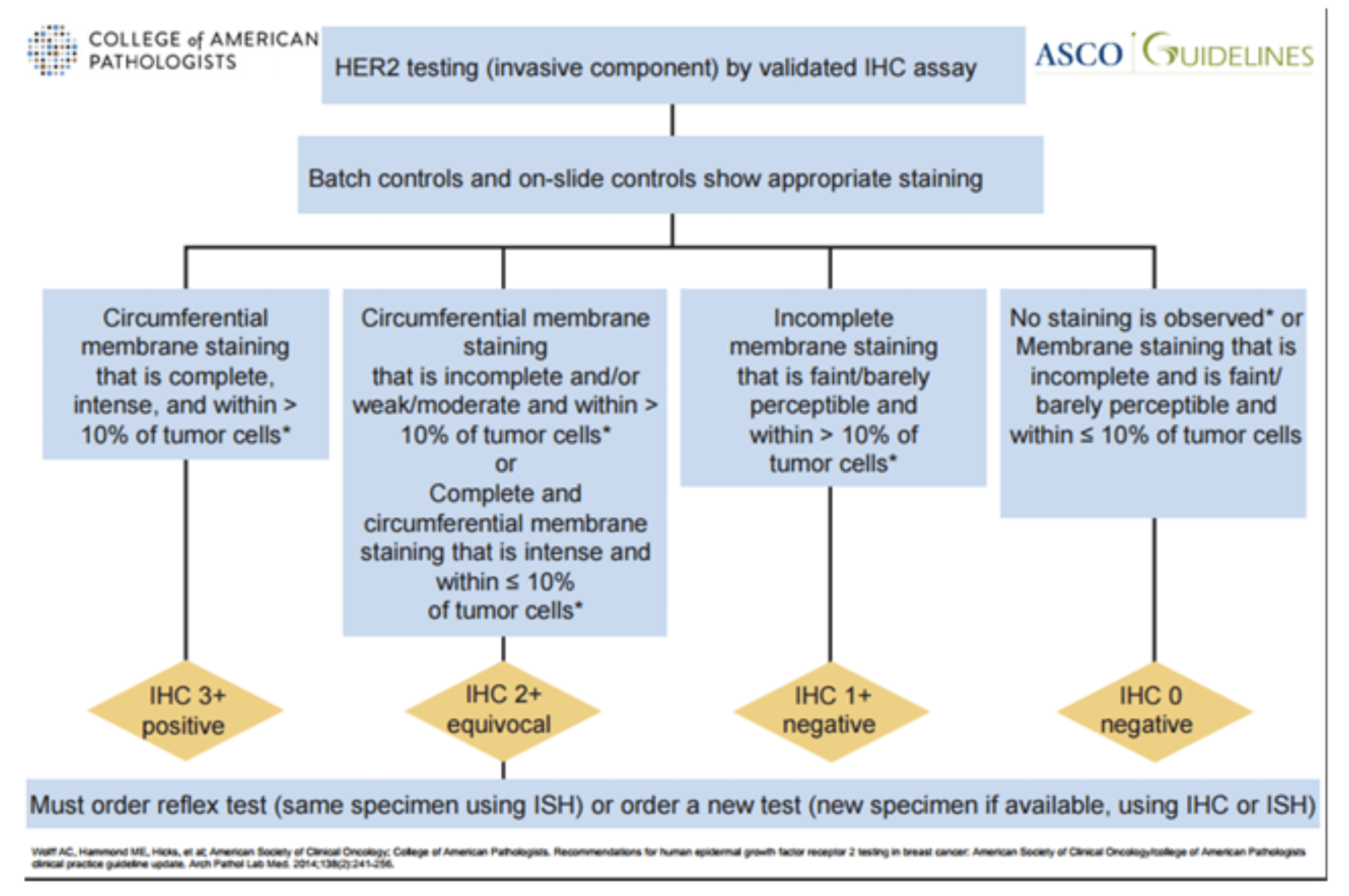
O HER-2 é um marcador prognóstico imuno-histoquímico de suma importância e que tem inúmeros estudos em andamento. Em 2013 a ASCO (Associação Americana de Oncologia Clínica) e o CAP fizeram um novo protocolo para a avaliação do HER-2 tanto por imuno-histoquímica quanto por Hibridização “In situ” (FISCH/CISH). Ainda em 2015 um novo update foi realizado para atualizar os critérios para o HER-2 2+ (duvidoso) (7, 8, 9 e 16).
Abaixo, esquema com os critérios atualizados:
Outro fator prognóstico avaliado e discutido é a presença de invasão perineural. No carcinoma de mama, assim como em outros carcinomas já bem documentados (próstata, cabeça e pescoço), a presença de infiltração perineural é um fator de risco para recorrência local (10).
A partir do estudo imuno-histoquímico também é possível obter a classificação molecular do câncer de mama, conforme tabela abaixo:
Entre os subtipos especiais de câncer invasivo da mama, podemos relacionar alguns (1 e 2):
- Carcinoma lobular (variantes clássica, pleomórfica, alveolar).
- Carcinoma misto (ductal com achados lobulares).
- Carcinoma mucinoso (coloide).
- Carcinoma tubular.
- Carcinoma com achados cribriformes.
- Carcinoma micropapilar.
- Carcinoma papilar.
- Carcinoma medular.
- Carcinoma metaplásico.
- Carcinossarcaoma.
- Carcinoma adenoide cístico, entre outros.
Outros fatores prognósticos incluem:
- Multicentricidade: dois focos neoplásicos com 5cm ou mais de distância entre um foco e outro.
- 2. Multifocalidade: quando os focos neoplásicos estão a uma distância inferior a 5cm.
A presença de neoplasia multifocal/multicêntrica tem importância prognóstica pelo risco aumentado de recidiva local (11, 12).
Avaliação imuno-histoquímica dos casos de neoplasias multicêntricas/multifocais: conforme explicado pela Dra. Daniella, a literatura só recomenda a avaliação imuno-histoquímica de mais de um foco neoplásico naquelas situações em que os fenótipos tumorais são distintos, por exemplo: um foco de carcinoma coloide/mucinoso e outro de carcinoma lobular ou quando o graduação entre os focos for diferente, por exemplo: um foco bem diferenciado e outro pouco diferenciado (13).
Dentre os subtipos especiais de câncer de mama os carcinomas metaplásicos costumam ser neoplasias de alto grau (histológico, nuclear e de índice mitótico). Entre os demais subtipos especiais em geral, a avaliação prognóstica acompanha os ítens das neoplasias ditas “não especiais” (14).
A avaliação transoperatória de linfonodo “sentinela” é um procedimento rotineiro e cientificamente comprovado como sendo eficaz para a avaliação prognóstica e para a tomada de decisão cirúrgica (esvaziamento axilar ou não) (15).
Conforme explicado, atualmente o exame transoperatório (“congelação”) consiste em um exame citológico (“imprint" + raspado), uma vez que os estudos mostraram que o uso do criostato está contraindicado pois o ato de congelar o material provoca alterações artefatuais que podem limitar ou mesmo impedir a análise adequada da amostra bem como o desgaste do material também pode influenciar no resultado podendo levar a falsos-negativos.
Os resultados possíveis em uma exame transoperatório são: positivo para células neoplásicas/negativo para células neoplásicas/aguardar parafina. Eventualmente, em especial mas não só nos casos de carcinoma lobular invasivo da mama, o patologista pode ter muita dificuldade em liberar um resultado conclusivo e nestes casos, pode ser necessário que se aguarde a confecção de lâminas após inclusão em parafina para o diagnóstico definitivo (17).
Após a inclusão em parafina, a análise dos cortes do linfonodo “sentinela" pode ter os seguintes resultados:
- NEGATIVO PARA MALIGNIDADE (AUSENTE METÁSTASE).
CÉLULAS NEOPLÁSICAS ISOLADAS: células isoladas ou pequenos grupamentos de células não maiores do 0,2mm e não mais do que 200 células (NUNCA ENTRA NA CONTAGEM TOTAL DE LINFONODOS COMPROMETIDOS)
- MICROMETÁSTASE: grupamento mais do 0,2mm e menor do que 2mm ou mais do que 200 células. Se único pN1(mi), se junto com macrometástase, entra na contagem total de linfonodos comprometidos
- MACROMETÁSTASE
Dr. Gianfranco Luigi Colombeli
Patologista
CRM-SC 10137. RQE 6702
Ref.:
- JAMA. 2015 Mar 17;313(11):1122-32.
- Tumour Biol. 2017 Apr;39(4):1010428317695023.
- Pathology. 2017 Feb;49(2):166-171.
- Int J Clin Exp Pathol. 2015; 8(9): 9772–9781.
- Int J Surg Pathol. 2017 Jun;25(4):298-303.
- Brachytherapy. 2017 May - Jun;16(3):552-564.
- Am J Clin Pathol. 2015 Dec;144(6):952-9.
- Oncotarget. 2016 Jun 21;7(25):38864-38875.
- J Breast Health (2013). 2016 Apr 1;12(2):78-82.
- PLoS One. 2015; 10(10): e0140652.
- J Oncol Pract. 2017 Mar;13(3):196-198.
Resumo Reunião Científica - Indicações de Radioterapia Pós Mastectomia
Reunião científica Sociedade Brasileira de Mastologia – Regional Santa Catarina
Palestrante:
Dr. Felipe Quintino Kuhnen
Indicações de Radioterapia Pós Mastectomia
A indicação de radioterapia pós mastectomia tornou-se assunto controverso após uma série de publicações mostrando que, diferente do Guideline da ASCO de 2001, onde definiu se que o critério para sua indicação seriam tumores T3 e T4, margens positivas, mais de 3 linfonodos comprometidos no esvaziamento axilar, a indicação poderia se estender também para condições onde a mastectomia foi realizada e foram encontrados de 1-3 linfonodos comprometidos, com benefício de redução dos índices de recorrência loco-regional e aumento sobrevida.
Em 2014 foi publicado no Lancet importante metanálise realizada pelo EBCTCG mostrando índices de RL muito superiores aos encontrados até então em grupo de pacientes com 1-3 linfonodos positivos que foram submetidas mastectomia sem posterior radioterapia complementar.
Com base nestes achados oncologistas, radioterapeutas e cirurgiões, representando a ASCO/ASTRO/SSO realizaram revisão sistemática de importantes publicações recentes e elaboraram novo guideline publicado no Journal of Clinical Oncology em novembro de 2016.
O Guideline atual da ASTRO/ASCO/SSO elucida 4 questões controversas:
1) A radioterapia pós mastectomia (PMRT) está indicada em doentes com tumores T1-2 com um a três linfonodos axilares positivos com dissecção dos linfonodos axilares ?
2) A PMRT está indicada em pacientes com tumores T1-2 e uma biópsia de linfonodo sentinela positiva que não se submetem à dissecção axilar ?
3)A PMRT está indicada em pacientes com câncer de Estágio I ou II que receberam terapia sistêmica neoadjuvante?
4)A irradiação nodal regional deve incluir os linfonodos mamários internos e/ou supraclavicular quando a PMRT é utilizada em pacientes com tumores T1-2 com um a três linfonodos axilares positivos?
Foram discutidos 4 casos clínicos baseados nessas questões e apresentado a conclusão do consenso para cada uma das questões:
1) Há evidência suficiente mostrando que a PMRT reduz o risco de recorrência loco-regional, recorrência a distância e mortalidade por câncer de mama em pacientes T1-2 com 1 a 3 linfonodos positivos. Entretanto, um grupo de pacientes podem ter um risco baixo de recorrência na qual o benefício da PMRT seria menor que o risco de potencial toxicidade (tumores T1, baixo grau, idade maior 45, receptores hormonais positivos, somente 1 linfonodo positivo) . Entretanto o painel não achou evidência científica suficiente para endossar um grupo específico de pacientes no qual a PMT não deveria ser administrada.
2) Não é apropriado a submeter as pacientes à potenciais toxicidades agudas e tardias da PMRT sem uma cuidadosa comparação com o esvaziamento axilar. Recomenda que essas pacientes recebam PMRT apenas se houver informação suficiente que radioterapia é necessária sem a necessidade de saber se outros linfonodos axilares estão comprometidos. Em outras palavras, naquela situação onde a radioterapia tenha indicação baseada em outros índices prognósticos além do comprometimento ganglionar, o esvaziamento poderia ser dispensado e a axila seria tratada pela radioterapia.
3) Pacientes com axila positiva após QT neoadjuvante devem receber PMRT. Dados observacionais sugerem baixo risco de recidiva loco-regional em pacientes com axila negativa que recebem QT neoadjuvante ou com resposta completa nos linfonodos. Entretanto não há evidência suficiente que a PMRT deva ser omitida neste grupo de pacientes.
4)Os volumes alvo mínimos obrigatórios para PMRT são a parede torácica e os nós apiculares axilares e supraclaviculares.Continua a haver controvérsia sobre quando os linfonodos da mamária interna e os linfonodos axilares de nível I e II se devem ser deliberadamente incluídos. Pode haver subgrupos que não se beneficiem de tratar ambas as áreas nodais em comparação com o tratamento de apenas a parede torácica ou a mama reconstruída ou uma área de drenagem. Tratamento da fossa supraclavicular e da mamária interna pode resultar em toxicidade adicional, com morbidade cardíaca e pulmonar, mesmo com técnicas avançadas de radioterapia.
Novos estudos estão em andamento com objetivo de analisar a necessidade de radioterapia em doença inicial ou em pacientes com resposta completa após neoadjuvância. Até este momento este guideline é a linha mais segura para avaliação do tratamento radioterápico complementar.
Dr. Felipe Quintino Kuhnen
CRM/SC 11859
Radio Oncologista do Imperial Hospital de Caridade
Radio Oncologista do Cepon
Radio Oncologista do Hospital São José - Criciúma
XVIII Encontro de Catarinense de Mastologia reúne associados em Lages
Confira resumos das apresentações que forma temas do XVIII Encontro de Catarinense de Mastologia.
Clique aqui para fazer download do conteúdo