Artigo Outubro de Prevenção - Presidente SBM/SC
30 de outubro de 2017Textos,Notícias
Destaque para artigo sobre o Outubro Rosa, assinado pelo presidente da SBM/SC, Cristiano Steil, publicado neste final de semana pelo Jornal Noticias Do Dia.
Acesse o artigo completo aqui: http://bit.ly/2gIcFqe

III Encontro Científico da Clínica Mastocentro
23 de outubro de 2017Associado,Notícias
Outubro foi o mês escolhido para se realizar práticas educativas sobre o câncer de mama, considerado o mais comum na mulher. De grande impacto social, envolve gastos públicos elevados no mundo inteiro, exigindo estratégias políticas e leis para garantir seu rastreio, diagnóstico, tratamento e seguimento. É fonte de incansáveis discussões e pesquisas, sempre na tentativa de comprovar que estamos indo no caminho certo e a enfrentando com as melhores armas.
Escolhemos a data de 29 de setembro de 2017 para receber o mês de outubro com nosso já tradicional evento, o III Encontro Científico da Clínica Mastocentro, realizado no Hotel Bourbon, na cidade de Joinville. O evento teve participação de diversas áreas médicas como: ginecologia e obstetrícia, cirurgia oncológica, oncologia, radiologia, radioterapia e anestesiologia, além dos mastologistas da região.
Como palestrantes, o renomado Dr. Jorge Villanova Biazús (RS) e a brilhante Dra. Linei Augusta Dellê Urban (PR) nos brindaram com aulas sobre o que já possuímos de melhor para testilhar o câncer de mama e forneceram algumas pinceladas do que o futuro possivelmente nos trará.
Exames Modernos
A triagem para câncer de mama mudou. Os mamógrafos cada vez mais modernos e digitais, já deixaram a mamografia analógica parecendo “retrô” e aparelhos de ultrassonografia com mais definição e recursos, como elastografia, quando utilizados em conjunto diminuem drasticamente os falsos negativos. A Tomossíntese tem papel bem definido e com a difusão do C-View, em alguns anos se tornará o método de escolha no rastreio.
Exames como a ultrassonografia automatizada de segunda geração e ressonância magnética fast possuem aplicabilidade internacional em pacientes de alto risco para câncer de mama e junto com a PET/MR (tomografia por emissão de pósitrons com a ressonância magnética de forma integrada e simultânea) poderão fazer parte do hall de exames de rastreio em casos especiais no futuro.
Testes Genéticos
Contamos ainda com importantes aliados, os testes genéticos. Os exames permitem identificar um grupo de risco e assim conseguimos dar atenção redobrada para esta população que tem um risco vitalício alto e atuar com práticas cirúrgicas e terapêuticas redutoras de risco.
Diagnóstico do Câncer de Mama
Apó o diagnóstico, o tratamento cirúrgico mamário também evolui a passos largos, tornando-se mais conservador e poupador. Quando possível, podem ser preservados mais pele, mais subcutâneo e mais linfonodos. Podemos manter a papila e aréola em mais casos. Diminuíram as margens necessárias para segurança oncológica e comprovaram isso com estudos. Nos casos em que há necessidade de mastectomia, lançamos mão de próteses anatômicas de ótima qualidade e de técnicas clássicas de reconstrução com retalhos cutâneos.
O futuro da Mastologia é instigante e impressionante. Vislumbramos uma possível redução no número de mutilações, como já vem sendo. Idealizamos um futuro de prevenção, diagnóstico precoce e tratamentos mais conservadores.
Quanto ao uso de toda essa nova tecnologia e ciência no serviço público, existe um abismo. Sabemos que sua aplicabilidade é incompatível em curto prazo, porém sempre se agrega um pouco do que temos a oferecer no serviço privado, essa é a grande importância da nossa atualização constante.
Para os colegas mastologista desejamos um Outubro Rosa que estimule ricas discussões, que agregue conhecimento, educação da população e consolide nosso papel de mastologistas em todas as fases do combate ao câncer de mama.
Equipe Mastocentro
Departamento de Mastologia da Sociedade Joinvillense de Medicina.
Lesões que desafiam o diagnóstico em Mastologia
20 de outubro de 2017Associado,Textos
Confira seleção de artigos científicos sobre o tema e disponíveis para download:





Resumo Reunião Científica - Lesões que desafiam o diagnóstico em Mastologia
20 de outubro de 2017Associado,Documentos
Reunião científica Sociedade Brasileira de Mastologia - Regional Santa Catarina
Palestrante:
Dra. Fernanda Laus Marins
Patologista | Macro & Micro - Anatomia Patológica
Debatedores:
Dra. Maria Luiza Nagel
Dr. Horácio Chikota
Dra. Cristina Marques Barreto
Lesões que desafiam o diagnóstico em Mastologia
Resumo Completo: Clique Aqui - Resumo Debate
Dra Fernanda Laus Marins
Especialista em Patologia
CRM-SC16013 / RQE 11287
Vídeo - Lesões que desafiam o diagnóstico em Mastologia
27 de setembro de 2017Associado,Vídeos
https://www.youtube.com/watch?v=tXrfe66DSBM
Resumo Reunião Científica: Controvérsias em Radioterapia
20 de setembro de 2017Associado,Documentos
Palestrante:
Dr. Carlos Lima Junior
Radiooncologista da Radioterapia São Sebastião, Florianópolis e Lages, Santa Catarina
Debatedores:
Dra. Cristiane Glavam
Dr. Felipe Quintino Kuhnem
Dra. Adriana Magalhães de O. Freitas
Controvérsias em Radioterapia
Adenomastectomia e a Potencial Indicação de Radioterapia Pós-Operatória
Embora a finalidade principal do tratamento cirúrgico dos tumores de mama seja o ótimo controle local, emergem, notadamente nos últimos anos, a satisfação das pacientes e os resultados cosméticos como efeitos secundários desejados. As chamadas mastectomias conservadoras, a skin-sparing mastectomy, que consiste na remoção da glândula mamária com a preservação da maior parte da pele; e a nipple-sparing mastectomy, que preserva tanto o envelope cutâneo como o complexo aréolo-papilar (CAP), constituem avanços na abordagem cirúrgica das neoplasias mamárias que visam a oferecer os benefícios primário (controle oncológico) e secundário (estético) às pacientes. Nossa discussão será focada nas nipple-sparing mastectomies ou adenomastectomias.
Até recentemente, havia muitas dúvidas acerca da segurança oncológica das adenomastectomias. Somente em 2016, o National Comprehensive Cancer Network (NCCN) admitiu, em seus guidelines, poder ser realizado o procedimento em situações selecionadas: tumores iniciais com biologia favorável (receptores hormonais positivos e HER-2 negativo), a pelo menos 2cm de distância do CAP, com exames de imagem pré-operatórios mostrando ausência de envolvimento tumoral mamilar, margem mamilar negativa à histologia da congelação, ausência de descarga papilar ou doença de Paget (1). Embora não haja parâmetros universalmente aceitos para sua realização, a maioria dos autores concorda com estas indicações, podendo ser acrescidas a exigência de tumores até 5cm e ausência de doença multifocal ou multicêntrica e de invasão vascular linfática (2). A segurança oncológica do procedimento foi atestada por estudos retrospectivos e prospectivos vários, além de algumas metanálises e revisões sistemáticas, que definiram as taxas de recidiva local.
A mais recente revisão sistemática, esta focada exclusivamente nas adenomastectomias, analisou 73 estudos retrospectivos ou prospectivos, envolvendo 12358 procedimentos e 10935 pacientes, com seguimento médio de 38,3 meses (3). As taxas de recidiva local, complicações globais e necrose mamilar foram, respectivamente, 2,38%, 22% e 5,9%. Tais números reforçam a segurança oncológica do procedimento, especialmente se se recorda que as mastectomias convencionais podem ter taxas de recidiva local tão altas quanto 16% (2). As complicações gerais e a necrose mamilar tenderam a decrescer com o tempo, como atestam os estudos posteriores a 2013 com menores taxas. Isto reflete o fato de que os cirurgiões estão se tornando mais confiantes e familiares com as técnicas o que, adicionalmente, como discutiremos, levou à expansão das indicações da adenomastectomia nos últimos anos.
Constitui preocupação de alguns clínicos se a permanência de alguma porção de tecido mamário residual pode resultar em altas taxas de recidiva local. Com efeito, um survey (questionário) aplicado a radiooncologistas europeus e norte e sul-americanos apontou a preocupação dos radiooncologistas no que tange à avaliação da quantidade de tecido mamário residual após mastectomias conservadoras (4). O estudo recomendou avaliação com exame de ressonância magnética e sugeriu indicação de radioterapia caso a espessura do retalho cutâneo superasse 5mm. Merecem destaque, contudo, alguns pontos da literatura. A cirurgia mais radical pode não representar garantia de clearance glandular completo, desde que tecido glandular residual pode ser detectado em 5% em biópsias pós-mastectomias convencionais (5). Não obstante possa se demonstrar tecido mamário residual em 59% das skin-sparing mastectomies, doença residual aparece em apenas 9,5% (6). Retalhos cutâneos podem exibir malignidade residual em até 23% dos casos (7). Apesar destes números potencialmente alarmantes, como já dissemos, a literatura não tem demonstrado taxas proibitivas de recidiva local ou no retalho cutâneo, voltamos a lembrar, apesar do risco de tecido mamário residual. Esta sociedade não endossa a indicação de radioterapia pós-operatória em função somente da efetuação da adenomastectomia sem a presença de fatores de risco clássicos para recidiva. Outrossim, considera não haver documentação definitiva na literatura do papel da avaliação do tecido mamário residual ou da espessura do retalho cutâneo com vistas a decidir sobre indicação de radioterapia adjuvante. Acrescente-se não haver critérios imaginológicos bem definidos para que se ateste tal espessura e nem mesmo exame de imagem delineado com este fim. A avaliação do tecido mamário residual e da espessura do retalho cutâneo são condutas a serem adotadas em base muito individual e sem apoio na literatura consultada.
Como mencionamos anteriormente, nos últimos anos, têm as indicações da adenomastectomia se expandido para além das clássicas recomendações (8, 9). Os resultados são aparentemente promissores para tumores maiores que os preconizados inicialmente, para tumores mais próximos do CAP e para pacientes submetidas a quimioterapia neoadjuvante. Excetuando-se as pacientes com nítido envolvimento clínico ou imaginológico do CAP, tumores localmente avançados com envolvimento cutâneo, tumores inflamatórios e descarga mamilar, as demais pacientes podem ter indicada adenomastectomia. Estudos mais maduros com maior período de seguimento são necessários, contudo, antes que possamos sugerir o procedimento além das indicações clássicas.
Radioterapia Axilar ou Esvaziamento Axilar?
Durante a cirurgia dos tumores de mama iniciais, pode-se poupar as pacientes do esvaziamento axilar, posto que é possível que elas sejam tratadas com irradiação axilar sem prejuízo dos resultados oncológicos. O estudo AMAROS (After Mapping of the Axilla: Radiotherapy Or Surgery) (10) randomizou pacientes com tumores cT1-2cN0 e um nodo sentinela positivo a esvaziamento ou irradiação axilares. No braço do esvaziamento, 609 pacientes foram tratadas com cirurgia conservadora de mama, ao passo que 127 o foram com mastectomia. Entre as irradiadas, havia 557 abordadas com cirurgia conservadora e 121, com mastectomia. Não houve diferença nas taxas de recorrência axilar (0,43% x 1,19% em 5 anos nos braços do esvaziamento e da radioterapia, respectivamente), sobrevida livre de doença ou sobrevida global nos dois grupos. Linfedema clinicamente detectado em 5 anos ocorreu em 11% das pacientes irradiadas e em 23% das esvaziadas, diferença que foi estatisticamente significante. Também estatisticamente significante foi a diferença do aumento de pelo menos 10% da circunferência do braço em 5 anos, que foram, respectivamente, 13% no grupo esvaziado e 5% no grupo irradiado. Tais resultados se repetiram no estudo randomizado húngaro OTOASOR (Optimal Treatment Of the Axilla - Surgery Or Radiotherapy) (11), publicado no corrente ano. O estudo também aleatorizou pacientes com tumores até 3cm e sem nodos palpáveis clinicamente e com nodos sentinelas positivos a esvaziamento ou irradiação axilares. Duzentas pacientes receberam cirurgias conservadoras e 44, mastectomia no grupo esvaziado, ao passo que 200 foram abordadas com cirurgias conservadoras e 30, com radioterapia axilar. Não diferiram estatisticamente a recorrência axilar (2% no grupo esvaziado e 1,7% no irradiado), a sobrevida livre de doença e a sobrevida global entre os dois grupos. A morbidade axilar foi maior também no grupo esvaziado neste estudo, com diferença estatística: qualquer sinal clínico de linfedema, parestesias, edema, dor no braço, imobilidade do ombro deu-se em 15,3% das pacientes esvaziadas e em 4,7% das pacientes irradiadas. Diante dos resultados destes dois estudos randomizados e considerando que quase 20% das pacientes foram mastectomizadas, é razoável concluir ser a radioterapia axilar indicada em caso de tumores iniciais com axila clinicamente negativa e com nodos sentinelas positivos em pacientes tratadas com cirurgia conservadora ou mastectomia. Havendo clara indicação de radioterapia, pode-se abdicar do esvaziamento axilar.
Revisão Bibliográfica
1.NCCN. NCCN clinical practice guidelines in oncology: breast cancer, version 1.2016.2016. https://www.nccn.org/professionals/physician_gls/f_guidelines.asp.
2.Mallon P, Feron JG, Couturaud B, et al. The role of nipple-sparing mastectomy in breast cancer: a comprehensive review of the literature. Plast Reconstr Surg 2013;131:969-84.
3.The oncological safety of nipple-sparing mastectomy: a systematic review of the literature with a pooled analysis of 12,358 procedures. Arch Plast Surg 2016;43:328-38.
4.Marta GN, Poortmans PM, Buchholz TA, Hijal T. Postoperative radiation therapy after nipple-sparing or skin-sparing mastectomy: A survey of european, north american, and south american practices. The Breast J, 2017:23:26-33.
5.Barton FE Jr, English JM, Kingsley WB, et al. Glandular excision in total glandular mastectomy and modified radical mastectomy: a comparison. Plast Reconstr Surg 1991;88:389-92.
6.Torresan RZ, dos Santos CC, Okamura H, et al. Evaluation of residual glandular tissue after skin-sparing mastectomies. Ann Surg Oncol 2005;12:1037-44.
7.Ho CM, Mak CK, Lau Y, et al. Skin involvement in invasive breast carcinoma: safety of skin-sparing mastectomy. Ann Surg Oncol 2003;10:102-7.
8.Smith BL, Tang R, Rai U, et al. Oncologic safety of nipple-sparing mastectomy in women with breast cancer. J Am Coll Surg 2017, doi:10.1016/j.jamcollsurg.2017.06.013.
9.Krajewski AC, Boughey JC, Degnim AC, et al. Expanded indications and improved outcomes for nipple-sparing mastectomy over time. Ann Surg Oncol 2015;22:3317-23.
10.Donker M, van Tienhoven G, Straver ME et al. Radiotherapy or surgery of the axilla after a positive sentinel node in breast cancer (EORTC 10981-22023 AMAROS): a randomised, multicentre, open-label, phase 3 non-inferiority trial. Lancet Oncol 2014;15:1303-1310.
11.Sávolt Á, Péley G, Polgár C, et al. Eight-year follow up result of the OTOASOR trial: The Optimal Treatment Of the Axilla - Surgery Or Radiotherapy after positive sentinel lymph node biopsy in early-stage breast cancer: A randomized, single centre, phase III, non-inferiority trial. Eur J Surg Oncol 2017;43:672-679.

Dr. Carlos Lima Junior
Especialista em Radiooncologia
CRM/SC 14673
Reunião da SBM/SC sobre a criação da Cooperativa Médica de Mastologistas de Santa Catarina
19 de setembro de 2017Associado,Notícias
No último sábado, dia 16 de setembro, aconteceu a primeira reunião oficial para discutir a criação da cooperativa dos mastologistas do Estado.
O encontro ocorreu na sede própria, dentro da Associação Catarinense de Medicina (ACM), em Florianópolis. Participaram membros da diretoria atual, Dr. Cristiano Steil (Presidente), Dr. Ygor Vieira de Oliveira (Vice-Presidente), Dra. Adriana Magalhães (Secretária) e Dr. Fernando Vequi (Tesoureiro), além dos colegas Dr. Geraldo Cassol (Joinville), Dr. Cortelazzo (Brusque), Dr. Luciano Rangel (Florianópolis) e Dra. Liliane Gomes (Florianópolis).
Em um primeiro momento, a Diretoria se reuniu com representantes jurídicos com experiência em cooperativas médicas de outras especialidades já existentes e que atuam com êxito no estado, a fim de compreender melhor todo o processo a ser executado.
Em seguida, com os demais colegas, foi realizada reunião complementar, para ouvir os questionamentos, anseios e perspectivas, além detalhar a discussão da pauta com os advogados. Vários encaminhamentos foram feitos a serem executados em um segundo momento.
A criação da cooperativa médica para os mastologistas catarinenses é uma das ações defendidas pela Diretoria, com a meta de fortalecer a especialidade e o especialista, em todos os aspectos.
Apesar de se tratar de um assunto complexo e dinâmico, a Diretoria acredita que esse primeiro esforço foi muito positivo e, em breve, a mesma promete comunicar aos associados os próximos trâmites a serem executados na concretização desse almejado objetivo.
A Mastologia de Santa Catarina só tende a crescer e se fortalecer quando o maior número de profissionais se compromete e compartilha com os mesmos ideais.
Atenciosamente
Diretoria triênio 2017-2019

Fernando Vequi Martins
CRM/SC13340 | RQE: 9867
Médico Mastologista
Resumo Reunião Científica – Câncer de mama em pacientes jovens e preservação da fertilidade
5 de setembro de 2017Associado,Documentos
Palestrante:
Dr. Tadeu Paiva Junior
Oncologista | Hospital A.C. Camargo e Clínica Soma
Debatedores:
Dra. Liliane Raupp G. Pizzato
Dr. Ricardo Nascimento
Dra. Aline da Rocha Lino
Câncer de mama em pacientes jovens e preservação da fertilidade
Resumo Completo: Câncer de Mama em Pacientes Jovens - Dr Tadeu Paiva Junior

Dr. Tadeu Paiva Junior
CRM/SP 118.637 CRM/SC 21.610
Oncologista | Hospital A.C. Camargo e Clínica Soma
Resumo Reunião Científica - Cirurgias redutoras de risco – Quando indicar?
28 de agosto de 2017Associado,Documentos
Reunião científica Sociedade Brasileira de Mastologia - Regional Santa Catarina
Palestrante:
Dra Juliana Koerich Laureano
Mastologista | Prefeitura do Município de Florianópolis, CEPON e Clinifemina
Debatedores:
Dra. Cristiane Fabiani
Dr. Erik Paul Winnikow
Dra. Pricila Bernardi
Cirurgias redutoras de risco – Quando indicar?
Resumo Completo: GEMA Cirurgias Redutoras de Risco

Dra Juliana Koerich Laureano
CRM/SC 16755 / RQE:14054
Mastologista | Prefeitura do Município de Florianópolis, CEPON e Clinifemina
Resumo Reunião Científica - Biópsias de mama: Quando indicar? Qual técnica escolher?
28 de agosto de 2017Associado,Documentos
Reunião científica Sociedade Brasileira de Mastologia - Regional Santa Catarina
Palestrante:
Dra Luciane Stüpp de Freitas - médica radiologista CEPON - Florianópolis - SC
Debatedores:
Dra Cristina Gaspar Salvador Tavares - médica radiologista clínica Sonitec - Florianópolis - SC
Dr Fernando Vequi Martins - médico mastologista clínica Le Santé - Lages - SC
Dr João Péricles da silva Jr. - médico patologista Hospital Universitárioio/UFSC e clínica IAP
Biópsias de mama: Quando indicar? Qual técnica escolher?
Métodos de Biópsias guiados por imagem
1) Punção Aspirativa por Agulha Fina (PAAF)
A PAAF é um procedimento simples, com baixas taxas de complicações e de baixo custo, podendo ser realizado facilmente em serviços de imagem. Entretanto necessita de indicações precisas e técnica adequada para se tentar evitar a amostragem insuficiente ao patologista e principalmente evitar falsos negativos. A presença do patologista em sala durante o procedimento reduz sensivelmente as amostras insuficientes e deve ser considerada sempre que possível.
Sabe-se que a sensibilidade da PAAF é menor em relação à da core biópsia (74% e 87%, respectivamente), porém suas especificidades são semelhantes (98% e 96%, respectivamente)8, o que pode ser útil quando se necessita de um diagnóstico rápido para a paciente.
A PAAF apresenta, entretanto, limitações importantes que interferem diretamente na conduta clínica, dentre as principais, a incapacidade da avaliação de receptores hormonais, a dificuldade na distinção de lesões invasivas e não invasivas, bem como a subestimação entre hiperplasia ductal atípica (HDA) e carcinoma ductal in situ (CDIS), além de ser incapaz de determinar a natureza benigna das calcificações4.
Desta forma é consensual na maioria dos artigos revisados algumas indicações específicas para PAAF, tais quais: esvaziamento de cistos, avaliação de linfonodo axilar em paciente com diagnóstico estabelecido de malignidade, bem como a necessidade de realização de diagnóstico rápido para lesão de alta suspeita como BI-RADS 5 ou lesões no leito da mastectomia.
Outras indicações que se pode consideradar a PAAF são lesões com baixa probabilidade de malignidade (BI-RADS 3) e lesões de difícil acesso com agulha mais calibrosa, como aquelas localizadas junto à parede torácica, bem como algumas limitações clínicas relacionadas à paciente e a intolerância aos outros procedimentos.
As contraindicações de PAAF formais são calcificações e áreas suspeitas para lesão esclerosante complexa (cicatriz radiada) ou carcinoma lobular invasor (CLI), estas últimas representadas por distorção arquitetural ou assimetria à mamografia.
Sabe-se que lesões maiores apresentam maior heterogeneidade na lesão, o que pode determinar menor sensibilidade da PAAF, sendo sugerido nestes casos evitar a PAAF e preferir a realização de biópsia por fragmento.
2) Biópsia por fragmento – core biópsia (CB)
É bem estabelecido que quanto maior o tamanho do fragmento (agulha), melhor a acurácia diagnóstica4, sendo observados na prática clínica bons resultados com a agulha de 14 Gauge (G). Entretanto, quando as lesões são muito pequenas ou mesmo nos linfonodos axilares, pode-se optar pela utilização de agulha de 16 G com a colocação de clipe de marcação da lesão, tanto na ultrassonografia quanto na mamografia.
O risco de subestimação dos achados da CB também pode ocorrer e deve-se ater principalmente a lesões com achado de HDA, que pode estar associada a CDIS ou mesmo carcinoma ductal invasor (CDI) entre 16% e 55% dos casos4. Os achados de cicatriz radial, lesões papilíferas, carcinoma lobular in situ (CLIS) e tumor filoide também podem ser subestimados e a necessidade de estrita correlação radiológica e patológica é fundamental na determinação destes casos, a fim de restringir ou não a indicação cirúrgica.
Dentro dos aspectos observados, a CB apresenta como principal indicação a avaliação de nódulos sólidos, com maior especificidade em lesões maiores em relação a PAAF, especialmente pela característica heterogênea destes nódulos, possibilitando a aquisição de maior quantidade de material em diferentes áreas da lesão. Além disso, calcificações, áreas de distorção arquitetural e assimetrias focais necessitam de maior amostragem de material para o diagnóstico adequado devido ao padrão histológico heterogêneo destes achados.
As contraindicações da CB estão relacionadas a contraindicações clínicas da paciente, devendo-se levar em consideração na escolha do método as principais vantagens e desvantagens, bastante enumeradas em diferentes estudos e revisões, sendo consenso entre as vantagens a possibilidade de avaliação do perfil hormonal das lesões, confirmação de lesão invasiva, boa distinção entre fibroadenoma e tumor filodes, boa correlação em lesões pequenas (< 1,0 cm e > 4,0 cm)10. Dentre as desvantagens podem ser consideradas o difícil acesso a lesões profundas, lesões papilíferas, necessidade de entrar e sair da mama com a agulha várias vezes, maior custo e tempo em relação à PAAF.
3) Biópsia assistida à vácuo BAV (mamotomia®)
Baseado no conceito em que o maior fragmento fornece o melhor diagnóstico, a BAV apresenta esta relação como principal diferencial, podendo chegar a uma acurácia diagnóstica de até 99%3, com menor subestimação de resultados e menor taxa de rebióspia4. A agulha calibrosa (de 7 a 12G) e aspiração à vácuo facilitam a aquisição dos fragmentos, sem a necessidade de retirada da agulha de dentro da mama, o que reduz a possibilidade de hematoma, o tempo de procedimento e também a chance de possíveis lesões cicatriciais no parênquima ou deslocamento de células epiteliais que possam simular invasão. Além disso, a BAV tem a possibilidade de realizar a excisão completa da lesão, o que no caso de lesões benignas é terapêutica, haja vista a boa concordância nos estudos clínicos com os achados de cirurgia.
As indicações são semelhantes às da CB, sendo mais bem indicada nos casos de calcificações, lesões pequenas (< 0,5 cm 3), lesões intraductais, lesões difusas ou inespecíficas, assimetrias ou alteração arquitetural e para retirada de lesões benignas (fibroadenoma/fibroadenoma like, cicatriz radial, lesões papilíferas). A clipagem do local abordado ocorre de rotina em lesões menores para posterior localização ou nos casos de pacientes a serem submetidas a quimioterapia neoadjuvantes, em que pode haver resposta completa.
Além disso é o único método possível de se utilizar quando é necessário guiar o procedimento por ressonância magnética.
A principal desvantagem da BAV é o alto custo do procedimento e baixa disponibilidade (grandes centros).
Qual método escolher?
Baseado na descrição acima, a escolha da técnica a ser utilizada, bem como o método de imagem para guiar o procedimento vai depender do aspecto da lesão e do potencial de malignidade esperado para tal. Fatores que precisam ser considerados envolvem o tamanho da lesão, as características clínicas e de imagem, a experiência do radiologista e do patologista, a necessidade de quimioterapia neoadjuvante ou de um resultado rápido e a tolerância da paciente ao procedimento.
E depois?
A determinação da concordância dos dados de imagem com o achado anatomopatológico é fundamental devido a heterogeneidade das lesões da mama, para enfim determinar a conduta final a ser adotada. Esta correlação final permite evitar a “perda” diagnóstica de falsos negativos e assim impedir o atraso no diagnóstico de câncer, sendo que o radiologista que realizou o procedimento o responsável pela correlação5, não se devendo excluir a interação com o médico assistente e com o patologista para finalização do caso.
Nos casos de lesões benignas concordantes não há uma normativa em como fazer o controle destas lesões e cada serviço determina a conduta a ser seguida, baseada nos diferentes estudos correlatos. Dentre as sugestões em diferentes estudos, as condutas de um controle em 6 meses ou controle semelhante a um achado BI-RADS®3 (6, 12 e 24 meses) são as mais adotadas nos principais serviços.
Conclusão:
Tanto a CB quanto a PAAF são modalidades de diagnóstico comuns e facilmente acessíveis no nosso meio e ambas apresentam limitações e vantagens. Porém diante do que se tem de conhecimento destes procedimentos recomenda-se preferir a CB a PAAF nas lesões de mama12,8.
A BAV deve ser considerada em casos específicos e ponderada devido ao alto custo de sua realização.
O quadro abaixo (adaptado4) mostra os diferentes métodos e suas principais indicações de uma maneira resumida:
| Lesão | PAAF | CORE | BAV |
| Nódulo | +
(> 1,0 cm - < 4,0 cm) |
+++ | +
(< 0,5 cm) |
| Calcificação | N/A | + | +++ |
| Assimetria focal ou Alteração arquitetural | N/A | + | +++ |
| Linfonodo axilar | +++ | + |
Cada serviço precisa adequar-se a sua realidade, procurar seguir as recomendações formais, porém dentro das suas limitações existentes fazer o possível para fornecer o melhor para cada paciente e consequentemente ter os melhores resultados e também a realização profissional.
Apêndice:
Linfonodos axilares
A avaliação da axila clinicamente negativa pode ser feita de maneira satisfatória pela ultrassonografia e os critérios ultrassonográficos de anormalidade mostram boa correlação com os achados da biópsia do linfonodo sentinela.
A PAAF pode ser considerada adicionalmente nos casos de ultrassonografia suspeita, porém o resultado negativo da PAAF não exclui a presença de metástase linfonodal e embora alguns dos conceitos a respeito da abordagem axilar venham se modificando a partir do estudo Z0011 – American College of Surgeons Oncology Group, habitualmente a pesquisa intraoperatória do linfonodo sentinela ainda é realizada. Uma alternativa à PAAF é a bióspia por agulha grossa (18 ou 16G), que apresenta maior acurácia, porém requer maior experiência do examinador e dispende de maior custo.
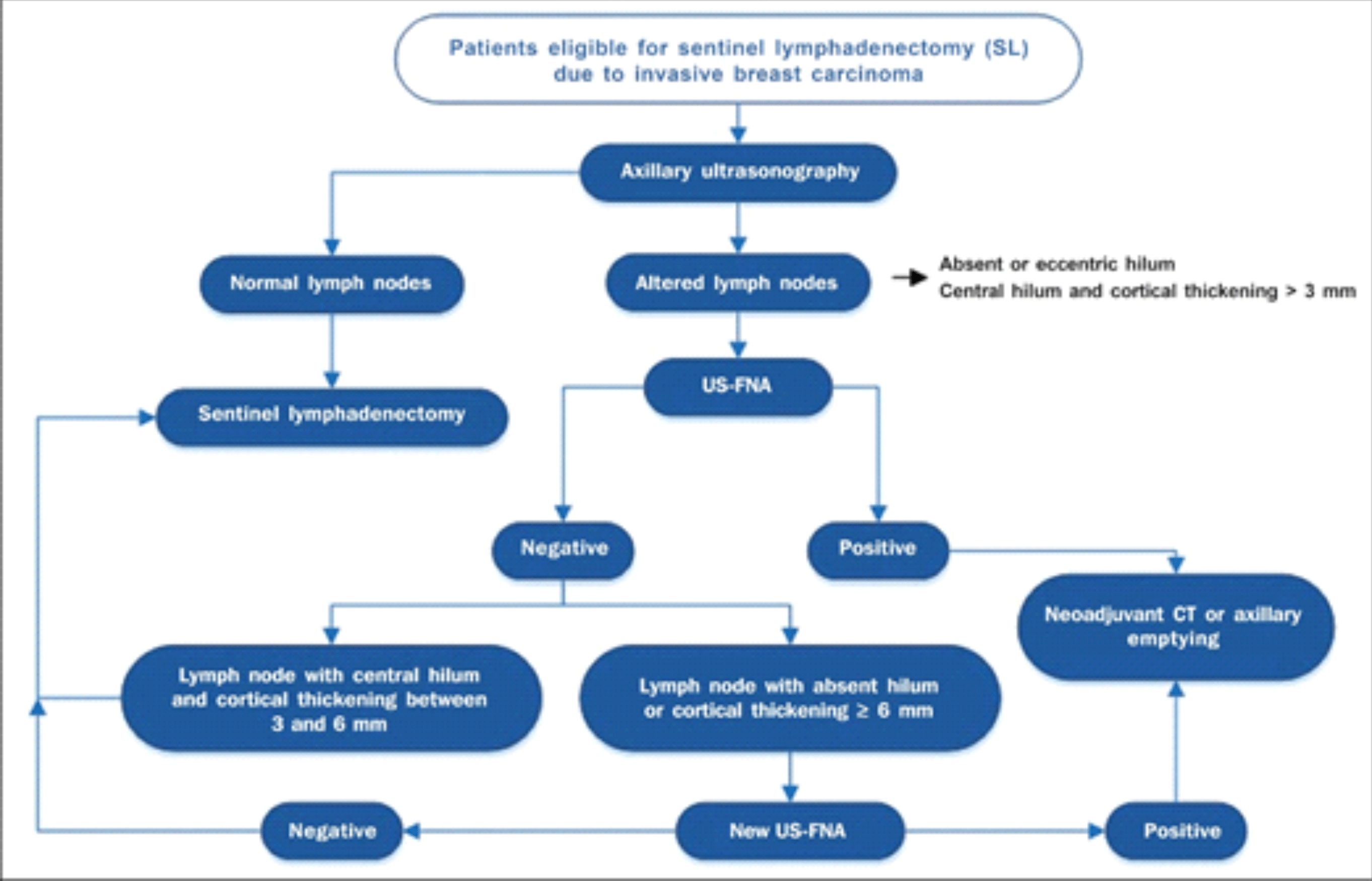
Desta forma alguns critérios merecem ser considerados na definição da doença nodal, havendo consenso na maior parte dos estudos revisados que o tamanho dos gânglios não deve ser considerado como critério para avaliação anatomopatológica. Os achados morfológicos, no entanto, são os principais requisitos para a decisão da investigação destes linfonodos, incluindo forma, espessamento cortical, estrutura do hilo e ecogencidade16. Para os casos de espessamento irregular da cortical, uma espessura maior que 3 mm já pode ser considerada suficiente para determinar a avaliação cito/histológica de estadiamento pré-operatório.
Dentro desta premissa, Rocha et al.17 propõe um algoritmo de avaliação axilar a partir da utilização inicial da ultrassonografia e seus critérios de inclusão para a realização da PAAF pré-operatória (anexo).
Anexo:
Algoritmo para a utilização da ultrassonografia axilar e da punção aspirativa por agulha fina (PAAF-US) na avaliação pré-operatória de pacientes com câncer de mama invasivo17.
Revisão bibliográfica:
- DOI 10.1053/crad.2001.0875 - Clinical Radiology 2002
- DOI 10.1002/dc.21433 - Diagnostic Cytopathology 2010
- DOI 10.1007/978-3-540-31611-4_2 - Recent Results in Cancer Research 2009
- DOI 10.1016/j.crad.2010.01.008 - Clinical Radiology 2010
- DOI 10.3348/kjr.2011.12.2.232 - Korean J Radiol 2011
- DOI 10.1016/j.rcl.2007.06.010 - Radiol Clin N Am 2007
- DOI 10.1148/radiol.13120985/-/DC1 - Radiology 2013
- DOI http://dx.doi.org/10.1016/j.breast.2016.11.009 - The Breast 2017
- DOI 10.1148/rg.2017160117 - Radiographics 2017
- DOI 10.1136/jclinpath-2011-200410 - J Clin Pathol 2012
- DOI 10.1007/s10549-010-0962-4 - Breast Cancer Res Treat 2010
- DOI http://dx.doi.org/10.1016/j.breast.2016.09.009 - The Breast 2016
- DOI 10.1111/his.12852 - Histopathology 2016
- DOI http://dx.doi.org/10.1590/0100-3984.2014.0110 - Radiol Bras 2016
- DOI 10.1001/jama.2015.1405 – JAMA 2015
- DOI 2214/AJR.16.16545 – AJR 2016
- DOI http://dx.doi.org/10.1590/0100-3984.2014.0121 - Radiol Bras 2015

Dra. Luciane Stüpp de Freitas.
Especialista em Radiologia e Diagnóstico por Imagem
CRM 11627/SC – RQE 10083